Narodowy Instytut Geriatrii, Reumatologii i Rehabilitacji
im. prof. dr hab. med. Eleonory Reicher
Klinika i Poliklinika Geriatrii
Spartańska 1, 02-637 Warszawa
Wielospecjalistyczny Szpital
Samodzielny Publiczny Zakład Opieki Zdrowotnej
Poradnia Kardiologiczna
Chałubińskiego 7, 67-100 Nowa Sól
ROZPRAWA NA STOPIEŃ DOKTORA NAUK MEDYCZNYCH
LEK. BARBARA DOMINIK
OCENA CZĘSTOŚCI WYSTĘPOWANIA EPIZODÓW OBJAWOWEGO
I BEZOBJAWOWEGO MIGOTANIA PRZEDSIONKÓW NA PODSTAWIE ANALIZY
ELEKTROKARDIOGRAMÓW WEWNĄTRZSERCOWYCH U PACJENTÓW Z
WSZCZEPIONYMI UKŁADAMI ICD I CRT-D
PROMOTOR: DR HAB. PRZEMYSŁAW MITKOWSKI, PROF. UM
I KLINIKA KARDIOLOGII UM IM. K. MARCINKOWSKIEGO W POZNANIUSPIS TREŚCI
SPIS TREŚCI ... 2 WYKAZ STOSOWANYCH SKRÓTÓW ... 4 1. WSTĘP ... 7 2. CELE PRACY ... 26 3. GRUPA BADANA ... 27 4. METODYKA ... 28 5. WYNIKI ... 325.1 Harmonogram rekrutacji chorych ... 32
5.2 Charakterystyka chorych włączonych do programu. ... 33
5.2.1. Charakterystyka demograficzna i kliniczna . ... 33
5.2.2 Typ wszczepionego urządzenia i obciążenie stymulacją. ... 35
5.3 Charakterystyka napadów migotań przedsionków występujących w grupie badanych chorych ... 36
5.3.1 Analiza częstości występowania napadów migotania przedsionków. ... 38
5.3.2. Analiza czasów trwania napadów migotań przedsionków u badanych chorych. ... 39
5.3.3 Analiza ładunków napadów migotań przedsionków u badanych chorych. ... 40
5.3.4 Występowanie objawów AF w grupie badanych chorych. ... 42
5.4 Identyfikacja chorych u których wystąpiły napady migotania (AF). ... 46
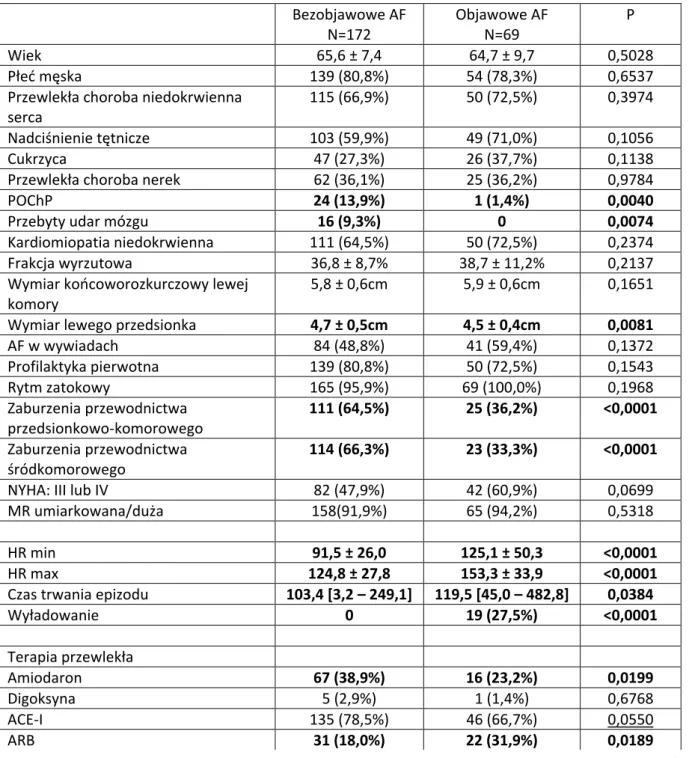
5.4.1 Porównanie danych demograficznych oraz parametrów klinicznych chorych, w zależności od występowania u nich AF. ... 46
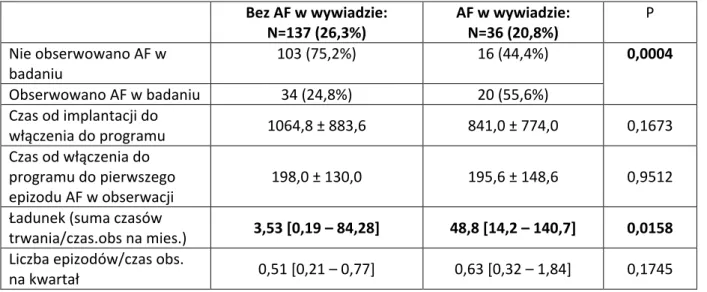
5.4.2 Częstość występowania napadów i ładunek AF w czasie obserwacji w zależności od występowania ich w przeszłości. ... 48
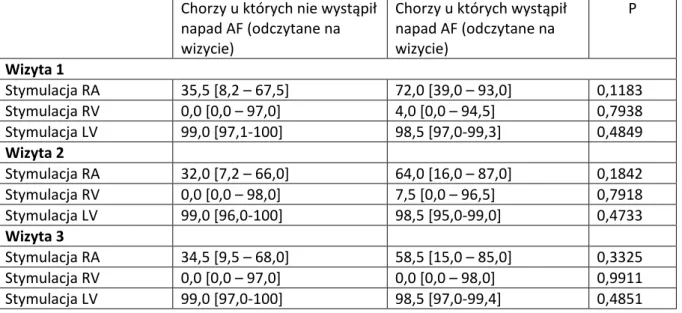
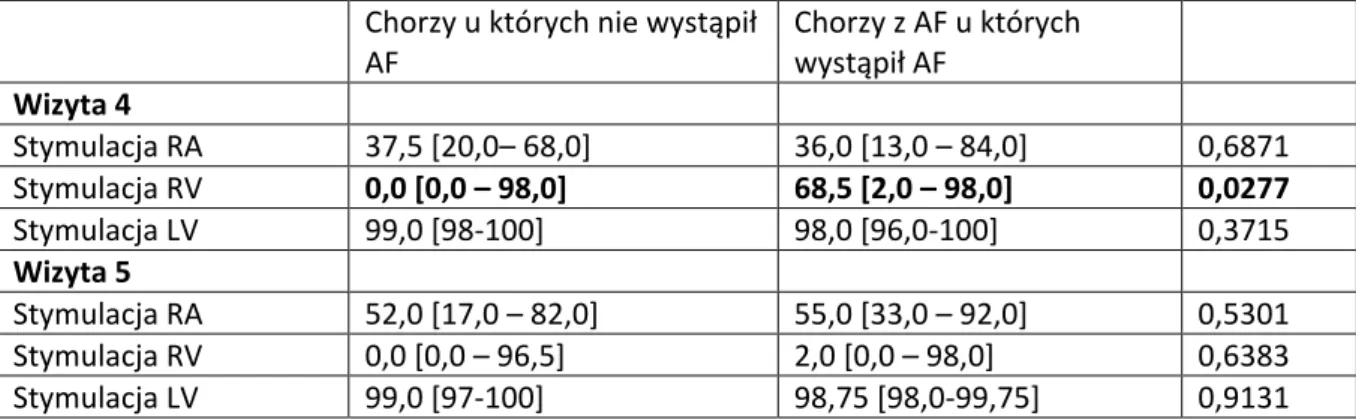
5.4.3 Częstość migotania przedsionków w różnych trybach stymulacji ... 49
5.4.4 Leczenie farmakologiczne ... 50
5.4.5 Leczenie inwazyjne. ... 51
5.5 Krzywe przeżycia chorych bez napadów AF ... 52
5.5.1 Występowanie AF u chorych w zależności od rodzaju stymulacji 52
5.5.2 Występowanie AF u chorych w zależności od obecności AF w wywiadzie. ... 54
5.5.3 Występowanie AF u chorych w zależności od występowania zaburzeń przewodzenia przedsionkowo-komorowego. ... 55
5.5.4 Występowanie AF u chorych w zależności od stopnia niedomykalności zastawki mitralnej ... 56
5.5.5 Występowanie AF u chorych w zależności od stopnia zaawansowania czynnościowego niewydolności serca wg NYHA. ... 57
5.6 Powikłania ... 59
5.6.1 Powikłania leczenia przeciwkrzepliwego ... 59
5.6.2 Śmiertelność ... 59
6. OMÓWIENIE I DYSKUSJA. ... 62
7. WNIOSKI ... 76
8. STRESZCZENIE W JĘZYKU POLSKIM ... 77
9. STRESZCZENIE W JĘZYKU ANGIELSKIM ... 79
4
WYKAZ STOSOWANYCH SKRÓTÓW
ACC- (ang. American College of Cardiology)
ACEI inhibitory enzymu konwertującego angiotensynę (ang. Angiotensin-Converting Enzyme Inhibitors)
AF- migotanie przedsionków (ang. Atrial Fibrillation)
AHA- Amerykańskie Stowarzyszenie Kardiologiczne (ang. American Heart Association) AHRE- szybkie rytmy przedsionkowe (ang. Atrial High Rate Episodes)
AMS- automatyczny tryb przełączania (ang. Automatic Mode Switch) ARB- blokery receptora angiotensyny (ang. Angiotensin Receptor Blockers) AT- częstoskurcz przedsionkowy (ang. Atrial Tachycardia)
ATP- stymulacja antyarytmiczna dla częstoskurczu komorowego (ang. Antitachycardia Pacing) BiV- stymulacja dwukomorowa (ang. Biventricular Stimulation)
CABG- pomostowanie aortalno-wieńcowe (ang. Coronary Arterial Bypass Graft)
CAD- choroba niedokrwienna serca, choroba wieńcowa (ang. Coronary Artery Disease) CCB- blokery kanału wapniowego (ang. Calcium Chanel Blockers),
CHA₂D-S₂-VASc- skala- C-zastoinowa niewydolność serca/dysfunkcja lewej komory (ang. Congestive Heart Failure/LV Dysfunction); H – nadciśnienie tętnicze (ang. Hypertension); A- wiek (ang. Age); D – cukrzyca (ang. Diabetes); S – udar mózgu (ang. Stroke); V- choroba naczyniowa (ang. Vascular Disease), Sc – płeć żeńska (ang. Sex Category);
CHF- zastoinowa niewydolność serca (ang. Congestive Heart Failure)
CIED- wszczepialne urządzenia do elektroterapii serca (ang.Cardiac Implantable Electronic Device)
CRT-D- stymulacja resynchronizująca z funkcją defibrylacji (ang. Cardiac Resynchronization Therapy with Defibrillator)
DCM- kardiomiopatia rozstrzeniowa (ang. Dilated Cardiomyopathy)
DDD- stymulacja przedsionkowo-komorowa hamowana odpowiednim rytmem przedsionków i/lub komór
EF- frakcja wyrzutowa (ang. Ejection Fraction)
EGM/IEGM- elektrogram wewnątrzsercowy (ang. Intracardiac Electrogram)
5 ESC- Europejskie Towarzystwo Kardiologiczne (ang. The European Society of Cardiology) FVT- szybki częstoskurcz komorowy (ang. Fast Ventricular Tachycardia)
HF- niewydolność serca (ang. Heart Failure) HR- częstość akcji serca (Heart Rate)
HRS- Amerykańskie Stowarzyszenie Rytmu Serca (ang. Heart Rhythm Society)
ICD- wszczepialny kardiowerter-defibrylator serca (ang. Implantable Cardioverter Defibrillator)
ICD-DR- wszczepialny kardiowerter-defibrylator serca dwujamowy z funkcją R (ang. Implantable Cardioverter Defibrillator)
ICD-VR- Wszczepialny kardiowerter-defibrylator serca jednojamowy z funkcją R (ang. Implantable Cardioverter Defibrillator)
ICM- wszczepialny kardiomonitor (ang. Implantable Cardiac Monitor)) ILR- wszczepialny rejestrator pętlowy (ang. Implantable Loop Recorder) IST- wyładowanie nieadekwatne (ang. Inappropriate Shock Therapy) KKCz- koncentrat krwinek czerwonych (pl.)
LAD- wymiar lewego przedsionka (Left Atrial Diameter) LBA- Leki β-adrenolityczne (pl.)
LV- lewa komora (ang. Left Ventricle)
LVEDV- objętość końcoworozkurczowa lewej komory (ang. Left Ventricular End-Diastolic Volume)
LVESV- objętość końcowoskurczowa lewej komory (ang. Left Ventricular End-Systolic Volume)
MR- niedomykalność mitralna (ang. Mitral Regurgitation)
NOAC- nowe doustne antykoagulanty (ang. Non-Vitamin K Antagonist Oral Anticoagulants) NT- nadciśnienie tętnicze (pl.)
NYHA- Nowojorskie Stowarzyszenie Kardiologiczne (ang. New York Heart Association) OAC- doustne antykoagulanty (ang. Oral Anticoagulants)
OR- iloraz szans (ang. Odds Ratio) PChN- przewlekła choroba nerek (pl.)
PK- przedsionkowo-komorowe zaburzenia przewodzenia (pl.) POChP- przewlekła obturacyjna choroba płuc (pl.)
6 PTCA- przezskórna plastyka wieńcowa (ang. Percutaneous Transluminal Coronary
Angioplasty)
RA- prawy przedsionek (ang. Right Atrium)
RF- ablacja z użyciem prądu o częstotliwości radiowej (ang. Radio Frequency Ablation) RM- zdalny monitoring (ang. Remote Monitoring)
RV- prawa komora (ang. Right Ventricle)
TIA- przemijające niedokrwienie mózgu (ang. Transient Ischemic Attack) VF- migotanie komór (ang. Ventricular Fibrillation)
VT- częstoskurcz komorowy (ang. Ventricular Tachycardia) VVI- stymulacja komorowa hamowana rytmem komór
7
1. WSTĘP
Elektroterapia serca jest uznaną metodą profilaktyki nagłego zgonu sercowego zarówno w prewencji pierwotnej jak i wtórnej.
Pierwsza implantacja automatycznego defibrylatora miała miejsce w 1980 roku. Po ponad trzech dekadach doświadczeń wprowadzono urządzenia o mniejszej masie i wielkości. Obecnie dostępne kardiowertery-defibrylatory dzięki wbudowanym algorytmom mogą dostarczać dwa rodzaje terapii antyarytmicznej: niskoenergetyczną stymulację antyarytmiczną (ATP) oraz wysokoenergetyczną kardiowersję i defibrylację. Dodatkowo mogą one dostarczać terapię antybradyarytmiczną – stosownie do wskazań oraz stymulację resynchronizującą, powodującą uporządkowanie sekwencji skurczu niewydolnej lewej komory. Kardiowertery-defibrylatory skutecznie przerywają przeważającą większość utrwalonych częstoskurczów komorowych i migotań komór oraz skutecznie zapobiegają bradykardii. Obecnie używane ICD mają rozwinięte funkcje dodatkowe: bezbólową terapię ATP w strefie detekcji migotania komór (VF), algorytmy redukujące prawdopodobieństwo wyładowań nieadekwatnych (wyzwalanych innymi czynnikami niż groźne komorowe zaburzenia rytmu) i zdalne monitorowanie podstawowych danych o pracy systemu oraz parametrów klinicznych, tzw. „remote monitoring”.
Pierwsze zalecenia ACC/AHA z 2002r. odzwierciedlały stale rosnące znaczenie implantowanych kardiowerterów-defibrylatorów (ICD), uważanych za niezbędne w terapii chorych po zatrzymaniu krążenia niezwiązanym z przejściowymi lub potencjalnie odwracalnymi przyczynami oraz dla chorych ze spontanicznym utrwalonym częstoskurczem komorowym (VT) związanym ze strukturalną chorobą serca.
W dokumencie tym podkreślono, że terapia ICD jest najbardziej skuteczna u chorych z utrwalonym częstoskurczem komorowym i upośledzoną funkcją skurczową lewej komory, podczas gdy VT powstający w strukturalnie prawidłowych sercach może być leczony farmakologicznie lub za pomocą ablacji RF. Dodano w nich także kolejne wskazania w klasie IIA obejmujące pacjentów z frakcją wyrzutową mniejszą i równą 30% zmierzoną po co najmniej miesiącu po zawale mięśnia sercowego i trzech miesiącach po pomostowaniu aortalno-wieńcowym. Odzwierciedlało to wyniki badań klinicznych dokumentujących
8 korzyści z zastosowania ICD w prewencji pierwotnej nagłego zgonu sercowego. Tylko ograniczone dane (klasa IIB) wspierały wówczas zastosowanie ICD u chorych z utratami przytomności nieznanego pochodzenia lub rodzinnym wywiadem stwierdzającym niewyjaśnione, nagłe zgony sercowe związane z morfologią zespołów QRS w badaniu elektrokardiograficznymi typowymi dla zespołu Brugadów. Stwierdzano, że implantacja ICD jest przeciwwskazana (klasa III zaleceń) u pacjentów, u których czynnik wyzwalający częstoskurcz komorowy lub migotanie komór może zostać zidentyfikowany, tak jak częstoskurcze komorowe rozwijające się w świeżym zawale mięśnia sercowego (do 48-godzin od początku objawów) lub w przebiegu zaburzeń elektrolitowych.
W 2008 roku zalecenia ACC/AHA/HRS1 uwzględniając wyniki badań IRIS i DEFINITE
(w zakresie ICD) oraz REVERSE, MADIT-CRT-D i RAFT (w zakresie stymulacji resynchronizującej) dołączyły dodatkowe wskazania do wszczepiania urządzeń z terapią wysokoenergetyczną. W klasie I rekomendacji znaleźli się pacjenci:
z pozawałową (minimum 40 dni po zawale) i „nieniedokrwienną” niewydolnością serca w klasie II- III wg NYHA z frakcją wyrzutową równą i niższą od 35% oraz
z EF równą i <40% oraz obecnym nieutrwalonym VT z powodu przebytego zawału serca lub wyindukowanym VT/VF w badaniu elektrofizjologicznym.
Uległy też poszerzeniu wskazania klasy IIA i IIB.
Wśród chorych z wszczepionymi urządzeniami, największą grupę stanowią pacjenci z objawową niewydolnością serca (klasa NYHA II - ambulatoryjna - IV).
Zarówno leczenie przy użyciu kardiowerterów–defibrylatorów w badaniu SCD-HeFT (2005) jak i stymulacja resynchronizująca w badaniach COMPANION (2004), CARE-HF (2005),
MADIT-CRT (2009) i RAFT (2010) udowodniły swoją skuteczność w zakresie redukcji
śmiertelności w niewydolności serca. ICD mogą być użyte jako samodzielne urządzenia lub w opcji ze stymulacją resynchronizującą (CRT-D). Wczesne wyniki obserwacji w badaniu
MADIT-CRT (2014) wykazały, że systemy ICD, w porównaniu do CRT-D, w mniejszym stopniu
redukują śmiertelność jedynie u pacjentów, którzy mieli w elektrokardiogramie blok lewej odnogi pęczka Hisa, a szerokość zespołu QRS była powyżej 130ms.2 Wcześniejsze badania wskazywały wartość powyżej 150ms.3
9 Obecnie chorzy z niewydolnością serca i obniżoną frakcją wyrzutową lewej komory poniżej 35%, według wytycznych ESC, mają wskazania klasy I do wszczepiania ICD w prewencji pierwotnej. ICD jest rekomendowane w celu redukcji ryzyka nagłej śmierci sercowej u chorych z etiologią niedokrwienną powyżej 40 dni od zawału serca z poziomem zaleceń IA, a u chorych z etiologią nieniedokrwienną poziom zaleceń to IB. Dla osób z niewydolnością serca, LBBB i szerokością QRS≥130ms, EF≤35% klasa zaleceń – IA do wszczepienia CRT-D.4
W ostatnim dziesięcioleciu obserwuje się stale rosnącą populację osób z wszczepionymi układami do kardiowersji-defibrylacji. Urządzenia do terapii wysokoenergetycznej mają za zadanie wykrywanie i dzięki odpowiedniemu zaprogramowaniu przerywanie groźnych dla życia arytmii komorowych. Na podstawie analizy sygnałów wewnątrzsercowych dochodzi do rozpoznania utrwalonego częstoskurczu komorowego lub migotania komór, a następnie dostarczenie przez urządzenie adekwatnej interwencji terapeutycznej.
Powszechnie znany jest fakt występowania u chorych leczonych wszczepialnymi kardiowerterami-defibrylatorami także nadkomorowych zaburzeń rytmu serca. Nie stanowią one bezpośredniego zagrożenia życia, mogą jednak być przyczyną nieadekwatnych wyładowań oraz wpływać na rokowanie odległe, w tym:
pogorszenie wydolności serca epizody zakrzepowo- zatorowe zwiększenie chorobowości wyższą śmiertelność.
Udowodniono, że przeżycie wyładowania zarówno adekwatnego jak i nieadekwatnego zwiększa ryzyko zgonu.5 Nieadekwatne wyładowania ICD są względnie częste i stanowią
potencjalne ryzyko wystąpienia zdarzeń niepożądanych. Mimo rozwoju technologii w zakresie urządzeń wszczepialnych dostarczających terapii wysokoenergetycznych, wyładowania nieadekwatne są jednym z nieodłącznych elementów życia pacjenta po przebytej implantacji. Dzieje się tak niestety nawet mimo implementacji najnowszych algorytmów pozwalających na dyskryminację nadkomorowych i komorowych zburzeń rytmu.
10 Nie eliminuje tego zjawiska zastosowanie nowych typów elektrod. Nieadekwatne interwencje zazwyczaj są bardzo źle tolerowane przez chorych. Pojawiają się w pełni świadomości przy braku poczucia zagrożenia życia, często w czasie aktywności fizycznej, niespodziewanie dla chorego, który nagle doznaje bólu związanego z wyładowaniem. Nieadekwatna terapia może wyindukować groźne dla życia zaburzenia rytmu – efekt
proarytmiczny.6 7 W przypadku takich epizodów mogą rozwinąć się stany lękowe i depresyjne. Jednocześnie drastycznie obniża się jakość życia chorego. Nie do pominięcia
jest również fakt szybszego wyczerpywania się baterii urządzenia w sytuacji powtarzających się, niepotrzebnych interwencji wysokoenergetycznych. Naraża to pacjenta na ryzyko powikłań (m.in. infekcyjnych i uszkodzenia elektrod) związanych ze zbyt częstą wymianą baterii, a co za tym idzie powtarzającymi się „otwarciami” loży urządzenia.8
Przyczynami nieadekwatnych interwencji ICD są tachyarytmie nadkomorowe, nadczułość urządzenia oraz uszkodzenia elektrod i związane z nimi artefakty stanowiące podstawę błędnej detekcji arytmii przez urządzenie. Największą trudność stanowią interwencje wywołane detekcją interwałów 250-275ms (240-220/min), które najczęściej znajdują się w strefie VF, gdzie rozpoznanie opiera się tylko o jedno kryterium – częstotliwości rytmu serca. Z drugiej strony, tego typu komorowe zaburzenia rytmu są źle tolerowane hemodynamicznie, więc wydłużanie czasu detekcji może okazać się niebezpieczne dla chorego. Częstoskurcze komorowe (zwłaszcza „wolniejsze”, modyfikowane często przez stosowane leczenie antyarytmiczne) w większości przypadków są dobrze tolerowane hemodynamicznie. Wydłużenie detekcji (zwiększenie liczby interwałów koniecznych do rozpoznania VT - przez urządzenie) jest jednym ze sposobów uniknięcia niepotrzebnej interwencji wysokoenergetycznej, gdyż często takie zaburzenia rytmu są samoograniczające.
Stwierdzono, że objawowe częstoskurcze najczęściej dotyczą częstotliwości powyżej 172/min (długość cyklu 350ms), ale zdarzają się też bezobjawowe VT 210/min (286ms), które samoistnie ulegają wygaszeniu i nie powodują wyzwolenia terapii ICD.
W badaniu PainFREE Rx II9 stwierdzono, że ponad 30% epizodów VT samoistnie
ustąpiło podczas ładowania kondensatorów przed wyzwoleniem terapii wysokoenergetycznej. Obserwacja ta stanowiła kolejną przesłankę skłaniającą do rozważnego programowania stref i kryteriów detekcji arytmii, ponieważ skutki wyładowania
11 ICD to nie tylko ból, ale i jego niekorzystny wpływ na jakość życia chorego (w tym na rozwój depresji i pojawienie się stanów lękowych). Znane są doniesienia mówiące, że prawidłowo rozpoznany VT może być skutecznie leczony u znacznego odsetka pacjentów (około 90%), u których wystąpiła arytmia (badanie PROVE), przy użyciu stymulacji antyarytmicznej (ATP). Powinno to skłaniać do tego, by w strefie VT programować tylko liczne, różniące się protokołem kombinacje ATP.
Niestety, nie jest to doskonałe rozwiązanie, bo w ten sposób część osób, u których terapia ATP nie jest skuteczna, będzie niepotrzebnie narażona na ryzyko niedostarczenia terapii wysokoenergetycznej w odpowiednim czasie, co może mieć bardzo poważne następstwa. Terapia ATP może w pewnych przypadkach spowodować zwiększenie częstotliwości VT (efekt proarytmiczny ATP). Wyżej przedstawione dane potwierdzają fakt, że nie ma doskonałej strategii programowania ICD, która z jednej strony zapewnia bezpieczeństwo chorego i zapobiega wystąpieniu objawów (omdlenia czy stany przedomdleniowe) związanych z groźnymi tachyarytmiami komorowymi, a z drugiej zapewnia wysoki komfort terapii. Dotyczy to zwłaszcza pacjentów z przewlekłą niewydolnością serca.
Udowodniono, że odpowiednie programowanie urządzeń wszczepialnych, opierające się na dostarczeniu terapii jedynie w przypadku rozpoznania najgroźniejszych komorowych zaburzeń rytmu, prowadzące do redukcji niepotrzebnych i nieadekwatnych wyładowań, związane jest ze zmniejszeniem śmiertelności ogólnej w okresie długotrwałej obserwacji.10
W badaniu (MADIT-RIT), które dotyczyło kardiowerterów-defibrylatorów dwujamowych (ICD-DR) i urządzeń resynchronizujących z funkcją defibrylacji (CRT-D), bardzo zaostrzono kryteria detekcji arytmii:
I-sze ramię: VT-1 - tylko monitorowanie 170/min.; VT-2 powyżej 200/min., interwencja po 2,5 sekundy opóźnienia;
II-gie ramię: VT-1 - powyżej 170/min., z czasem opóźnienia interwencji do 60 s; VT-2 równe i powyżej 200/min., z 12s opóźnienia; VT-3 równe i większe od 200/min., 12s opóźnienia interwencji;
12 Sprowadzenie programowania detekcji arytmii do jedynie wysokich częstotliwości rytmu (powyżej 200/min.) lub wydłużenie czasu trwania detekcji (częstoskurcz komorowy trwający co najmniej 60 sekund), związane było z ok. 75% redukcją ryzyka wystąpienia pierwszej terapii nieadekwatnej i ok. 50% redukcją śmiertelności ogólnej.
Każdy z producentów ICD stara się, aby jego urządzenia wszczepialne w jak największym odsetku przypadków podejmowały prawidłowe decyzje terapeutyczne (detekcja arytmii), a co za tym idzie dostarczały jedynie uzasadnionych i skutecznych terapii.
W urządzeniach firmy ST. JUDE MEDICAL zmodyfikowano parametry fabryczne zgodnie z technologią Shock Guard i algorytmem Decision Tx, które dzięki zaawansowanej technologii detekcji umożliwiają unikanie wyczuwania sygnałów nieprawidłowo interpretowanych jako załamki R (np. załamek T) i zastosowanie kilku schematów ATP mających na celu niskoenergetyczne (bezbolesne) przerywanie tachyarytmii komorowych. W ICD firmy SJM poprawie rozpoznania VT/VF ma sprzyjać zwiększenie liczby pobudzeń niezgodnych z wzorcem rytmu nadkomorowego (z 5/8 do 7/12) rejestrowanych w IEGM. Ponadto wprowadzenie konieczności spełnienia 2 z 3 kryteriów potwierdzenia komorowego pochodzenia rytmu ma przyczynić się do poprawy swoistości bez pogorszenia czułości rozpoznania i redukcji liczby dostarczonych nieadekwatnych interwencji. Istotną zmianą jest także podwyższenie progów detekcji i zwiększenie liczby interwałów potrzebnych do podjęcia decyzji o dostarczeniu terapii, co pozwala na uniknięcie interwencji w przypadku „wolnych” i samoograniczających się częstoskurczów komorowych. Zaprogramowanie ATP jako terapii pierwszego wyboru w każdej strefie jest bardzo ważnym elementem strategii pozwalającej zredukować liczbę bolesnych interwencji wysokoenergetycznych.
Zalecane parametry ICD firmy MEDTRONIC powstały w oparciu o wyniki badań
PainFREE RxI i II, EMPIRIC, WAVE i PREPARE. Istotną zmianę przyniosło wprowadzenie do
produkcji urządzeń, które w strefie VF mogą jako pierwszą terapię zastosować niewyczuwalną przez pacjenta terapię ATP. Dotychczas było to możliwe jedynie przez odpowiednie programowanie strefy FVT. W profilaktyce pierwotnej zaleca się ponadto u pacjentów wydłużenie czasu detekcji zamiast dotychczasowych 18 z 24 (18 z kolejnych 24 pobudzeń spełnia kryteria detekcji) na 30 z 40, co pozwoli na samoistne ustępowanie części
13 u których wszczepiono ICD w ramach prewencji wtórnej nagłego zgonu sercowego detekcję arytmii należy wydłużyć do 16 z 24.
Programowanie urządzeń firmy BOSTON SCIENTIFIC zostało zminimalizowane i ułatwione przez określenie stanu funkcjonalności układu bodźcoprzewodzącego pacjenta
oraz występowanie zaburzeń rytmu. W zależności od występującej patologii, kombinacja odpowiedzi na cztery pytania pozwala automatycznie zmienić ponad 200 parametrów ICD. Właściwa ocena występowania nadkomorowych zaburzeń rytmu i dobrze zebrany wywiad oraz analiza dokumentacji dotyczącej wcześniejszego występowania komorowych tachyarytmii prowadzi do intuicyjnego programowania i przyczynia się do oszczędzania czasu poświęcanego na standardową kontrolę chorego.
W kontekście zmniejszenia ryzyka niepotrzebnych wyładowań, a tym samym lepszego różnicowania arytmii komorowej i nadkomorowej pojawia się kwestia wyboru jedno- lub dwujamowego urządzenia. Oprócz odpowiedniego programowania, rozbudowa pewnych algorytmów, jak np.: ocena niestabilności rytmu, a w urządzeniach dwujamowych dodatkowo analiza sekwencji i liczby odczytanych sygnałów przedsionkowych przypadających na liczbę sygnałów komorowych (A/V), daje teoretycznie możliwość lepszej detekcji arytmii nadkomorowych. Dlatego implantując urządzenie być może należy brać pod uwagę nie tylko klasyczne wskazania do stymulacji. Hipotetycznie w urządzeniach z dodatkową detekcją w przedsionku należy spodziewać się lepszej kwalifikacji arytmii, ponieważ elektroda przedsionkowa dostarcza dodatkowo informacji o wewnątrzsercowych sygnałach przedsionkowych, czego nie można osiągnąć z pojedynczej elektrody umieszczonej w komorze. W pierwszym, badaniu porównującym skuteczność urządzeń jedno- i dwujamowych w różnicowaniu arytmii nadkomorowej i komorowej, ku zaskoczeniu stwierdzono, że ICD-DR częściej dostarczał nieadekwatnych wyładowań. Mogło to wynikać z konstrukcji samego protokołu badania.11 Badanie DETECT SVT było kolejnym, mającym określić skuteczność dwujamowego ICD w dyskryminacji częstoskurczów nad- i komorowych.12 W badaniu tym urządzenia dwujamowe w porównaniu do jednojamowych charakteryzowały się mniejszą liczbą błędnych detekcji, choć różnica skuteczności zależała w dużej mierze od typu arytmii. Ponadto stwierdzono, że urządzenia ICD-DR nie zmniejszają liczby pacjentów doznających nieadekwatnych terapii, a jedynie zmniejszają liczbę wyładowań na osobę (obciążenie wyładowaniami indywidualnego chorego).
14 Badanie DATAS wykazało z kolei mniejsze ryzyko zgonu z jakiejkolwiek przyczyny, nieadekwatnych wyładowań oraz długotrwałych częstoskurczów nadkomorowych u chorych z dwujamowym ICD w porównaniu do jednojamowego.13
W innym randomizowanym badaniu dokonano analizy porównawczej powikłań i śmiertelności wewnątrzszpitalnej w grupie 104 049 pacjentów, którym po raz pierwszy wszczepiono kardiowerter-defibrylator (grupa ICD-DR: 62%, grupa ICD-VR: 38%). Stwierdzono, istotną statystycznie wyższą śmiertelność wewnątrzszpitalną u chorych z ICD-DR względem chorych z ICD-VR (0,4% vs 0,23% p<0,001). Ponadto implantacja urządzenia dwujamowego związana była z większym kosztem samej procedury, a także wyższym ryzykiem powikłań okołozabiegowych, takich jak: odma opłucnowa, krwiak, dyslokacja elektrody, czy zakrzepica żylna w porównaniu do implantacji urządzenia jednojamowego (3,17 vs 2,11% , p<0,001).14
Poza standardowymi układami z osobną elektrodą przedsionkową i komorową, które mają być pomocne w rozwiązywaniu problemu dyskryminacji arytmii komorowej i nadkomorowej (zwłaszcza migotania przedsionków) istnieją systemy jednoelektrodowe z tzw. pływającym dipolem przedsionkowym (system DX firmy BIOTRONIK działający w oparciu o elektrodę Linox Smart DX), umieszczanym na wysokości prawego przedsionka. Elektroda ta pozwala na rzeczywistą rejestrację aktywności elektrycznej przedsionka przez dodatkowe dwa pierścienie umieszczone na elektrodzie defibrylującej komorowej, bez konieczności doszczepiania drugiej elektrody (przedsionkowej). Zastosowanie systemu DX ICD pozwala nie tylko na rozróżnianie nadkomorowej tachyarytmii od komorowej, ale także na wcześniejsze, wiarygodne rozpoznanie epizodów migotania przedsionków, a tym samym wdrożenie stosownego leczenia, w tym doustnej antykoagulacji. W niedawno opublikowanym badaniu, do którego włączono 249 chorych, randomizowanych do jednojamowego układu z detekcją przedsionkową lub standardowego układu dwujamowego, nie stwierdzono istotnych różnic w częstości występowania powikłań w czasie implantacji, jak i obserwacji odległej. Jednocześnie porównywany czas implantacji był istotnie krótszy dla układu DX, a skuteczność rozpoznania napadowej arytmii przedsionkowej nie różniła się istotnie.15
Kolejną ciekawą opcją jest wprowadzenie do jednojamowych kardiowerterów-defibrylatorów (ICD-VR) algorytmu rozpoznawania migotania przedsionków stosowanego wcześniej w rejestratorach zdarzeń. Opiera się on na analizie zmienności odstępów RR
15 sygnału wewnątrzsercowego w okresie 2 minut. Po rozpoznaniu epizodu migotania przedsionków fragment wewnątrzsercowego ekg jest zapisywany w pamięci urządzenia w celu weryfikacji trafności rozpoznania. Czułość rozpoznania migotania przedsionków w oparciu o dane z wszczepialnych rejestratorów pętlowych (ILR – Implantable Loop Recorder) w rozpoznawaniu AF wynosiła 96,1%, a swoistość 85,4%.16 Wyniki uzyskane z urządzeń wszczepialnych, w których „detektor” znajduje się w prawej komorze, a nie pod skórą, jak w przypadku ILR, powinny być więc jeszcze dokładniejsze.
Większość napadowych arytmii u chorych z niewydolnością serca (HF – Heart Failure) stanowi migotanie przedsionków. Szacuje się, że niezależnie od przyczyny HF, migotanie przedsionków występuje u około 40% chorych. W związku ze starzeniem się społeczeństwa i wydłużaniem średniego czasu życia, także u chorych z niewydolnością serca, problem arytmii nadkomorowej będzie narastał. Część tych zaburzeń ma charakter napadowy i może być zarówno objawowa, jak i bezobjawowa. Oblicza się, że aż 25% udarów tzw. o nieznanej przyczynie może mieć podłoże arytmiczne. Subkliniczne migotanie przedsionków może być w tym wypadku czynnikiem etiologicznym.17
W badaniu Framingham zaobserwowano, że ryzyko udaru mózgu wzrasta 4,8 razy u chorych z migotaniem przedsionków w porównaniu do pacjentów bez tej arytmii.18 Dodatkowo wśród sercowo-naczyniowych czynników ryzyka udaru, jedynie obecność AF ma wpływ na częstość jego wystąpienia i wpływ ten wzrasta wraz z wiekiem. Ryzyko udaru związane z tą arytmią wzrasta z 1,5% w populacji w wieku 50-59 lat do 23,5% w grupie 80-89 lat. Szacunkowe dane wskazują, że w 2050 roku liczba chorych z tą arytmią zwiększy się co najmniej 2,5-krotnie.
Udary niedokrwienne wtórne do AF charakteryzuje nie tylko większa śmiertelność w trakcie ostrego epizodu, ale także powikłania odległe – większy stopień kalectwa i większe ryzyko ponownego udaru. Dlatego w ostatnim czasie przeprowadzono kilka badań poświęconych roli AF u chorych z kryptogennym udarem niedokrwiennym mózgu (EMBRACE i CRYSTAL AF). W pierwszym z nich porównywano wartość diagnostyczną monitorowania rytmu serca przez 30 dni przy użyciu zewnętrznego rejestratora zdarzeń mającego funkcję automatycznego rozpoznawania AF u chorych po epizodzie udaru kryptogennego, z 24-godzinnym monitorowaniem ekg metodą Holtera. Przedłużone monitorowanie rytmu serca znacznie częściej umożliwiło wykrycie tej arytmii (16,1% vs 3,2%).19
16 W badaniu CRYSTAL-AF w podobnej, lecz młodszej populacji, porównano monitorowanie rytmu serca przy użyciu wszczepialnego rejestratora EKG (ILR) ze standardowym postępowaniem diagnostycznym (standardowym ekg, 24-godzinnym monitorowaniem ekg metodą Holtera lub użyciem zewnętrznego rejestratora zdarzeń). Do badania włączono 168 pacjentów z udarem niedokrwiennym o nieznanej przyczynie. Implantowano u nich pętlowy rejestrator zdarzeń i obserwowano przez 345 dni w kierunku napadowego migotania przedsionków, które definiowane było jako niemiarowy rytm serca bez załamków P trwający minimum 30s. Arytmia wystąpiła u 30 pacjentów (18%). Na podstawie danych z rejestratora dokonano symulacji rozpoznania migotania przedsionków przy użyciu innych technik monitorowania: pojedynczego ekg, krótkookresowych (24-, 48-godz. i 7-dniowa rejestracja Holtera, 21- i 30-dniowy rejestrator zdarzeń) oraz okresowych,
powtarzanych (raz na miesiąc rejestracja 24-godzinna, raz na kwartał rejestracja 24-,
48-godzin i siedmiodniowa). Czułość powtarzanych, a zwłaszcza jednorazowych, krótkookresowych rejestracji zapisu ekg była bardzo niska w porównaniu do 345-dniowej rejestracji ciągłej (ILR). Wynosiła od 1,3 do 22,8% odpowiednio dla pojedynczej 24-godzinnej rejestracji systemem Holtera i 30-dniowego rejestratora zdarzeń. Godny podkreślenia jest fakt, że aż 23 pacjentów (77% pacjentów z rozpoznanym AF) miało co najmniej jeden dzień (w okresie obserwacji) z epizodami arytmii trwającymi minimum 6 minut. Mediana czasu do rozpoznania pierwszego napadu AF wynosiła 8,4 miesiąca, a 81% tych napadów było bezobjawowych. W grupie ILR, w porównaniu z grupą standardowego postępowania diagnostycznego, stwierdzono większe prawdopodobieństwo rozpoznania AF trwającego ponad 2 minuty: 8,9% vs 1,4% w okresie 6 miesięcy obserwacji i odpowiednio 30% vs 3% po 36 miesiącach.20 21 Uzasadniono więc jednoznacznie potrzebę długoterminowego monitorowania rytmu serca w poszukiwaniu AF jako przyczyny udaru kryptogennego. Jednocześnie rozpoznanie tej arytmii implikuje decyzje terapeutyczne – wdrożenie leczenia przeciwkrzepliwego.
W metaanalizie ośmiu badań klinicznych, do których włączono w sumie 2900 pacjentów z migotaniem przedsionków, porównując grupę leczonych doustnymi antykoagulantami (OAC) z grupą placebo, stwierdzono, występowanie udaru w ciągu roku odpowiednio u 2,2 i 6,0% badanych.22 Bezwzględne zmniejszenie ryzyka udaru wynosiło 2,7% u chorych stosujących OAC w prewencji pierwotnej i 8,4% stosujących go w prewencji wtórnej.
17 Bezobjawowe migotanie przedsionków, stanowi bardzo duży problem diagnostyczny. Zasadne jest więc aktywne poszukiwanie napadów AF u chorych z wysokim ryzykiem zakrzepowo-zatorowym (np. u chorych z wartością wskaźnika CHA₂D-S₂-VASc ≥2).
W badaniu CARISMA epizody migotania przedsionków dłuższe niż 30 sekund, związane były z ryzykiem ważnych zdarzeń sercowych:
niewydolności serca, ponownego zawału,
zwiększenia śmiertelności sercowo-naczyniowej.23
W innym doniesieniu stwierdzono, że bezobjawowe tachyarytmie przedsionkowe występują często u pacjentów ze stymulatorami i defibrylatorami. Związane są z istotnie podwyższonym ryzykiem niedokrwiennego udaru mózgu i zatoru obwodowego. Badana grupa chorych często rozwija klinicznie objawową formę migotania przedsionków.2425
W terapii resynchronizujacej kluczowym zagadnieniem jest uzyskanie blisko 100% skutecznej stymulacji dwukomorowej.26 Przyczyną braku możliwości uzyskania takiego odsetka stymulacji jest często obecność arytmii. Nawet krótkotrwałe, napadowe migotanie przedsionków (definiowane jako częstotliwość rytmu przedsionkowego powyżej 180/min przez więcej niż 10 min/dzień) zanotowane w pamięci urządzenia powoduje gorszą odpowiedź na CRT-D. W takiej grupie chorych obserwuje się także więcej adekwatnych wyładowań z powodu arytmii komorowych, wyładowań nieadekwatnych oraz hospitalizacji z powodu niewydolności serca.27
CRT poprawia funkcję lewej komory i ogólną kondycję chorego niezależnie od wieku. Śmiertelność ogólna w tej grupie chorych związana jest m.in. z brakiem odpowiedzi na terapię resynchronizującą tzw. „non-responder”, obecnością migotania przedsionków oraz brakiem adekwatnej terapii farmakologicznej niewydolności serca.28
Publikacja on-line Dauberta i wsp.29 formułuje kilka wniosków. AF i tachyarytmie przedsionkowe przyczyniają się do suboptymalnej odpowiedzi na CRT, bowiem szybki rytm hamuje stymulację, jest nieregularny i powoduje utratę funkcji lewego przedsionka. Wcześniejsze badania po interrogacji pamięci urządzenia, określały skumulowane ryzyko
18 nowego AF na ok 7% chorych z łagodną niewydolnością serca i 30% dla postaci bardziej zaawansowanej HF.30 31 Skłonność jest dwa razy większa u pacjentów z wywiadem arytmii nadkomorowej.32 Wartość prognostyczna nowo powstałego AF jest niepewna. W badaniu
MADIT-CRT kliniczna korzyść z CRT w porównaniu do ICD nie zmniejszała się
w zależności od wywiadu AF lub jego pojawienia się w trakcie obserwacji.33 W przeciwieństwie do tych danych pozostaje Italian Registry. Powyżej 10 minutowy epizod tachykardii nadkomorowej wykryty przez urządzenie związany jest z ryzykiem braku odpowiedzi na stymulację resynchronizującą („non-responder”), wzrostem ryzyka zgonu i hospitalizacji z powodu niewydolności serca.34 Te rozbieżne informacje tłumaczy się różnymi protokołami obydwu prób, badanymi populacjami pacjentów i obecnością napadowego oraz nienapadowego migotania przedsionków.
Migotanie przedsionków (AF) to choroba postępująca. Historia naturalna zwykle rozpoczyna się od rzadkich i krótkich, samoograniczających się epizodów, tzw. napadowe migotanie przedsionków (samoistne ustąpienie w ciągu tygodnia), poprzez występowanie przetrwałego AF (nie ustępuje spontanicznie do 7 dni i wymaga kardiowersji), długo trwającego, przetrwałego AF (powyżej roku, ale z planowaną kardiowersją) aż do utrwalonego AF (arytmia powyżej roku bez kardiowersji lub gdy ta jest nieskuteczna). Objawowe migotanie przedsionków jest powodem obniżenia jakości życia chorego. Najczęściej wymieniane objawy arytmii to:
kołatanie serca, uczucie niemiarowości, palpitacje;
krótki oddech (duszność) i zmniejszenie tolerancji wysiłku; zmęczenie, osłabienie;
poty;
omdlenia lub zawroty głowy;
utrata przytomności (często w zespole tachy-brady);
19 Na wzór skali NYHA stworzono klasyfikację objawów związaną z zaburzeniami rytmu serca – tzw. skala EHRA:35
I - bez objawów podmiotowych;
II – objawy łagodne – objawowe AF bez ograniczenia normalnej codziennej aktywności; IIa - brak dolegliwości związanych AF; IIb - pacjent ma dolegliwości z powodu AF; III – objawy ciężkie – normalna codzienna aktywność jest ograniczona;
IV – objawy uniemożliwiające funkcjonowanie – normalna, codzienna aktywność w ogóle nie jest możliwa.
Możliwy jest też przebieg bezobjawowy („ciche AF”) i wówczas arytmię rozpoznaje się przypadkowo lub gdy wystąpią jej powikłania.
Obecna praktyka kliniczna dotycząca rozpoznania migotania przedsionków opiera się na konieczności udokumentowania go w zapisie ekg, co pozwala na spełnienie ustanowionego kryterium diagnostycznego.36 Dokumentacja ta ma najwyższą wagę, ponieważ stanowi podstawę do dalszych interwencji terapeutycznych, jak strategia kontroli rytmu lub włączenie doustnego leczenia przeciwkrzepliwego. Udokumentowanie AF zapisem ekg, niesie ze sobą jednakże dwa wyraźne ograniczenia. Po pierwsze, wydarzenie jest nieprzewidywalne co do określenia czasu początku i długości trwania epizodu arytmii. Po drugie, objawy prezentowane przez chorego mają ograniczoną wartość identyfikującą epizod arytmii i co za tym idzie uniemożliwiającą wykonanie niezbędnego do rozpoznania zapisu ekg. Ponadto liczne badania opisują wysoką skłonność do asymptomatycznych i cichych AF w różnorodnych populacjach pacjentów.37 Aby lepiej scharakteryzować arytmię i wprowadzić stosowne interwencje terapeutyczne dąży się do coraz bardziej intensywnego monitorowania rytmu serca stosując różnorodne techniki. Tradycyjne: fragment zapisu (tzw. pasek strip) ekg, 12-odprowadzeniowego ekg, 24-godzinnego monitorowania metodą Holtera 7 dniowego zapisu Holtera oraz transmisji telefonicznej ekg. W rzeczy samej, wszystkie te metody to techniki przerywanej obserwacji, nie rozwiązujące jednak zasadniczego problemu skutecznego określania początku i czasu trwania epizodu AF.38
Dokładnej informacji dotyczącej AF można oczekiwać tylko z danych uzyskanych i gromadzonych podczas ciągłego monitorowania rytmu. Wgląd taki mamy u pacjentów
20 z rozrusznikami serca. Poszczególne badania pokazują dużą liczbę asymptomatycznych, niezdiagnozowanych epizodów AF z istotnymi implikacjami klinicznymi (np. epizodami zakrzepowo-zatorowymi). Prowadzone były obserwacje na populacji chorych z rozrusznikami serca, które oceniają, że subkliniczne AF występuje u 10% chorych (minimum 6 min epizod migotania w obserwacji 3-miesięcznej), przy czym odsetek ten wzrasta do 16% w grupie chorych, którzy przebyli udar kryptogenny (równy i 30-sekundowy epizod podczas miesięcznej obserwacji). Dane te dotyczą specyficznej grupy pacjentów, co sprawia, że przenoszenie tych „znalezisk” na populację ogólną chorych z AF ma pewne ograniczenia.3940 Umożliwienie ciągłego monitorowania tej arytmii u pacjentów bez klasycznych wskazań do stymulacji poprzez zastosowanie rejestratorów pętlowych (ILR-AF), dedykowanych do wykrywania migotania przedsionków, jest obecnie poddawane ocenie, ze szczególnym uwzględnieniem precyzji diagnostycznej i wartości klinicznej wczesnego wykrywania AF.41
Dane uzyskiwane w trakcie kontroli i analiza zapisów IEGM z urządzeń wszczepialnych mają bardzo wysoką wartość diagnostyczną w wykrywaniu migotania przedsionków. Nasuwają się jednak pewne pytania. Czy implikacje kliniczne wykrycia takiej arytmii są jednoznaczne i powodują konieczność włączenia leczenia przeciwkrzepliwego? Jakie kryteria czasowe trwania AF należałoby przyjąć za granicę, przy której warto włączyć takie leczenie uwzględniając oczywiście skalę CHADS₂VASC?
Osoby, które z racji wskazań, mają wszczepione urządzenia stymulujące i/lub do terapii wysokoenergetycznej, posiadają więc specjalne układy, które po odpowiednim zaprogramowaniu, śledzą zarówno rytm serca, jak i jego zaburzenia. Rozpoznane zaburzenia rytmu są przez nie rejestrowane, a fragmenty elektrokardiogramów wewnątrzsercowych gromadzone w ich pamięci. Okresowo wykonywane zapisy EKG i rejestracje Holterowskie są zwykle podstawą do rozpoznania napadów nadkomorowych zaburzeń rytmu serca. Urządzenia wszczepialne, ze względu na czas monitorowania rytmu serca - cały okres żywotności urządzenia - cechują się znacznie wyższą czułością w tym względzie niż metody standardowe. Systematyczne kontrole chorych ze stymulatorami i kardiowerterami-defibrylatorami, które odbywają się raz na 3-6 miesięcy mają na celu głównie analizę skuteczności stymulacji i wystąpienie terapii antyarytmicznych. Pozostałe dane dotyczące epizodów arytmii nadkomorowych dają możliwość modyfikacji leczenia (np.: włączenie leków antyarytmicznych, przeciwkrzepliwych, poprawiających wydolność serca) oraz
21 kwalifikacji do leczenia inwazyjnego (ablacji, wykonania koronarografii czy kardiowersji elektrycznej).
Wysoka czułość diagnostyki migotania przedsionków na podstawie danych z urządzeń wszczepialnych powoduje pojawienie się istotnych pytań dotyczących interpretacji uzyskanych wyników i określenia wartości progowych dla uznania epizodu migotania przedsionków za istotny klinicznie (tzn. zwiększający ryzyko udaru mózgu i/lub zatorowości obwodowej). Wartość progu obciążenia AF związaną ze znaczącym wzrostem ryzyka udaru jest wciąż poddawana badaniom i dyskusjom, jednak jasnym jest, że maksymalny dzienny ładunek AF (burden AF)≥1h niesie ze sobą negatywne implikacje prognostyczne.42
Pojawia się także pytanie na ile wiarygodna jest ocena występowania tachyarytmii nadkomorowych na podstawie algorytmów detekcji zawartych w urządzeniach wszczepialnych?
Na podstawie analizy grupy 2580 chorych uczestniczących w badaniu ASSERT i danych uzyskanych z pamięci urządzenia rozpoznano 5769 epizodów szybkich rytmów nadkomorowych (definiowanych jako arytmia trwająca nie mniej niż 6 minut o częstotliwości rytmu przedsionków powyżej 190/min). Wśród nich, 82,7% stanowiły rzeczywiste epizody tachyarytmii nadkomorowej, pozostałe, 17,3% fałszywie dodatnio rozpoznane epizody (na podstawie analizy elektrokardiogramów wewnątrzsercowych), zaklasyfikowane zostały jako powtarzające się epizody nie-nawrotnej synchronii komorowo-przedsionkowej. Odsetek fałszywie dodatnich rozpoznań malał wraz z wydłużaniem kryterium czasu trwania tachyarytmii nadkomorowej i wynosił odpowiednio: 6,8 oraz 3,3 i 1,8% dla kryterium 30min, 6 i 24 godziny.43
W innym badaniu z 2007r. (A-HIRATE in Pacemaker Patients Trial) prawidłowe rozpoznanie przez stymulator szybkich rytmów przedsionkowych wynosiło 93% spośród wszystkich przeanalizowanych epizodów arytmii.44
Nasuwają się dodatkowe pytania. Czy AF trwające kilka do kilkudziesięciu sekund ma takie samo znaczenie kliniczne jak to, które trwa godziny i dni? Czy ważniejszy jest czas trwania pojedynczego epizodu, czy raczej suma czasów trwania wszystkich epizodów w analizowanej jednostce czasu? 45
22 Wystąpienie przynajmniej jednego bezobjawowego epizodu o czasie trwania powyżej 6 min i częstości przedsionków powyżej 190/min w okresie trzech miesięcy od wszczepienia urządzenia zwiększało 2,5-krotnie ryzyko udaru w okresie 2,5-rocznej obserwacji.46
W badaniu TRENDS, obejmującym ostatecznie 2486 chorych, u których dysponowano co najmniej 30-dniowym okresem rejestracji danych we wszczepionym urządzeniu, dokonywano analizy występowania napadów AT/AF w 30-dniowych przedziałach czasowych. U 76% badanych nie stwierdzono występowania AT/AF, u 12% maksymalny czas trwania wszystkich AT/AF w jednym dniu badanego przedziału nie przekraczał 5,5 godz., a u kolejnych 12% był większy niż 5,5 godziny. Ryzyko epizodu zakrzepowo-zatorowego wynosiło w okresie 1,4-letniej obserwacji 1,1% na rok. Przy czym 1,1 i 2,4% na rok, odpowiednio w grupie bez AT/AF, w porównaniu z grupą dłuższego niż 5,5 godziny AT/AF. Po wyłączeniu epizodów przejściowego niedokrwienia mózgu ryzyko to wynosiło: 0,5 oraz 1,1 i 1,8% na rok odpowiednio dla grupy bez AT/AF, z AT/AF≤5,5h i AT/AF˃5,5h.47
Prawdopodobieństwo udaru rośnie wraz z wydłużaniem maksymalnego czasu trwania tej arytmii w ciągu dnia od 1,2% u chorych z epizodami poniżej 5 min do 4%, jeżeli epizody przekraczają 24 godziny.48 Analizując występowanie arytmii nadkomorowej u 10016 pacjentów po wszczepieniu stymulatora serca, kardiowertera-defibrylatora lub systemu do stymulacji resynchronizujacej w okresie 24-miesięcznej obserwacji, stwierdzono wystąpienie minimum jednego dnia z przynajmniej 5-min sumarycznym czasem trwania tej arytmii u 43% badanych. Po uwzględnieniu różnic w wartości wskaźnika CHADS₂ oraz stosowanej doustnej antykoagulacji między analizowanymi podgrupami z różnym maksymalnym ładunkiem dobowym AF stwierdzono, że wartość ładunku 1 godz. najbardziej różnicuje grupy z wysokim i niskim ryzykiem udaru (HR 2,11), a ryzyko udaru u osób z ładunkiem ≥ 1 godz. wynosi u nich 1,72%. Należy jednak podkreślić, że wystarczające jest nawet występowanie epizodów o sumarycznym czasie trwania równym i powyżej 5min/dobę, aby doszło do wzrostu ryzyka udaru o 1,76 razy.49
Wysoka czułość i swoistość rozpoznania migotania przedsionków w oparciu o analizę pamięci urządzeń znalazła swoje odzwierciedlenie w opublikowanych w 2016 roku zaleceniach Europejskiego Towarzystwa Kardiologicznego dotyczącego diagnostyki leczenia migotania przedsionków.
23 W dokumencie tym uwzględniono znaczenie epizodów szybkich rytmów przedsionkowych (AHRE – atrial high rate episodes) wykrytych przez urządzenia wszczepialne u chorych bez AF. Jeżeli AHRE trwa ˃5-6 minut i ma częstotliwość rytmu powyżej 180/min. należy wykonać ocenę chorego wg skali CHA₂DS₂VASc, następnie jeżeli zostanie udokumentowane AF (ekg spoczynkowe, Holter ekg, ekg z zapisu urządzenia), należy włączyć leczenie przeciwkrzepliwe.50
W ostatnim czasie rośnie liczba publikacji dotyczących zdalnego monitorowania chorych z urządzeniami wszczepialnymi. Udowodniono, że jest to metoda, która poprawia współpracę z chorym, zwłaszcza młodym, poniżej 40 r.ż., w mniejszych ośrodkach klinicznych oraz w określonych obszarach geograficznych.51 Znacząco poprawia wyniki odległe leczenia u chorych z niewydolnością serca i wszczepionym ICD lub CRTD.52 Jest narzędziem stanowiącym skuteczną profilaktyką nieadekwatnych wyładowań spowodowanych migotaniami przedsionków u chorych z niewydolnością serca po implantacji ICD/CRTD.53 Podsumowując, zdalne monitorowanie urządzeń jest rzeczywistym i przydatnym narzędziem diagnostycznym pozwalającym na wczesne wykrywanie, odpowiednie leczenie i efektywny monitoring chorych z urządzeniami wszczepialnymi.54 Dzięki rozwojowi transmisji danych, informacje zebrane przez wszczepione urządzenia mogą być niemal natychmiast dostępne dla lekarzy sprawujących opiekę nad pacjentem. Z jednej strony technologia ta pozwala na wykrycie nawet bardzo krótkich, bardzo często bezobjawowych epizodów AF, a z drugiej strony lekarz w krótkim czasie od pojawienia się epizodu jest informowany o jego wystąpieniu, dzięki temu chory, który do tej pory nie miał rozpoznanej arytmii, może mieć włączone wczesne leczenie przeciwkrzepliwe. Dotychczas nie zbadano jednak, czy doustna terapia antykoagulantami, ordynowana w oparciu o uzyskane telemetrycznie dane z wszczepionych urządzeń kardiologicznych, zmniejsza częstość występowania powikłań takich jak: udary mózgu, zatory obwodowe, czy też duże krwawienia w porównaniu z postępowaniem konwencjonalnym.
W 2012r. wprowadzono w Europie aplikację o nazwie Discovery Link AFinder umożliwiającą identyfikowanie pacjentów z wykrytym przez CIEDs migotaniem przedsionków i przesłanie tej informacji na odpowiednią platformę przy użyciu telemonitoringu. Celem opublikowanego na łamach PACE badania była ocena przydatności klinicznej tej aplikacji w wykrywaniu AF u chorych z wszczepionymi urządzeniami kardiologicznymi, którzy byli
24 poddani telemetrycznej kontroli tychże urządzeń. W badaniu brało udział siedem włoskich ośrodków, w których włączano kolejnych pacjentów z wszczepianymi zgodnie z obowiązującymi wytycznymi rozrusznikami dwujamowymi serca, kardiowerterami-defibrylatorami lub układami resynchronizujacymi firmy Medtronic. Pacjenci otrzymywali system do telemetrycznej kontroli urządzenia (Medtronic CareLink Network). Aplikacja AFinder to program systematycznie skanujący otrzymane za pośrednictwem CareLink transmisje w poszukiwaniu chorych z wykrytym przez urządzenie migotaniem przedsionków trwającym co najmniej 6 minut na dobę. Ponadto system umożliwia również, po wprowadzeniu danych podstawowych pacjenta, ocenę ryzyka powikłań zakrzepowo-zatorowych chorego wg skali CHA2-DS2-VASc. Urządzenia rozpoznawały AF, jeśli częstość w kanale przedsionkowym przekraczała 171/min przez co najmniej 32 pobudzenia komorowe i w tym okresie częstość w kanale przedsionkowym była wyższa niż w komorowym. Głównym celem badania była ocena użyteczności platformy w poprawie wykrywania AF i leczenia doustnymi antykoagulantami. Do badania włączono 472 chorych. W całej badanej grupie 44% chorych miało w wywiadzie przed wszczepieniem urządzenia napady AF. Badanie podzielono na dwie fazy: pierwsza - 12-miesięczna – kontrole w warunkach ambulatoryjnych i poprzez zdalne monitorowanie (RM – Remote Monitoring), druga - z włączoną aplikacją AFinder.
Na koniec pierwszej fazy badania 57% chorych miało rozpoznane AF, na koniec drugiej fazy arytmię przedsionkową miało 63% badanych. Spośród 244 chorych z arytmią w pierwszej i drugiej fazie badania, ponad połowa (56%) miała napady trwające dłużej niż 1 dobę, 138 chorych miało epizody dłuższe niż 12 godzin, a 179 badanych napady AF trwające co najmniej 1 godzinę. Wyjściowo przed badaniem doustne leki przeciwkrzepliwe stosowało 140 pacjentów. Na podstawie rozpoznania napadów z pierwszej fazy badania leki te włączono kolejnym 30 chorym, a w drugiej fazie następnym 11 (uwzględniając oczywiście czynniki ryzyka).
Aplikacje dodatkowo wykrywające migotanie przedsionków u chorych z CIEDs umożliwiają lepszą identyfikację chorych z napadami AF i mogą przyczynić się do poprawy diagnostyki i zwiększenia liczby pacjentów ze wskazaniami do profilaktyki epizodów zakrzepowo-zatorowych lekami przeciwkrzepliwymi.55
25 Celem opublikowanego na łamach Eur Heart badania IMPACT (Combined Use of BIOTRONIK Home Monitoring and Predefined Anticoagulation to Reduce Stroke Risk) było porównanie skuteczności leczenia przeciwkrzepliwego włączanego i kończonego w oparciu o dane uzyskane przy zastosowaniu telemonitoringu wszczepionych urządzeń kardiologicznych w porównaniu z postępowaniem tradycyjnym. W badaniu nie wykazano
przewagi strategii wczesnego włączania leczenia przeciwkrzepliwego u chorych z implantowanym ICD bądź CRT-D i epizodami szybkich rytmów nadkomorowych (AT-atrial
tachycardia) wykrytymi przez urządzenie i przesłanymi przy użyciu telemonitoringu, a następnie przerywania leczenia w przypadku braku epizodów arytmii przedsionkowej w dalszej obserwacji w porównaniu z postępowaniem tradycyjnym. Nie wykazano również związku czasowego pomiędzy epizodami AT, a powikłaniami zakrzepowo-zatorowymi.56
Na podstawie analizowanego piśmiennictwa odnoszącego się do detekcji arytmii innej niż komorowa przez urządzenia wszczepialne, ocena częstości występowania epizodów objawowego i bezobjawowego migotania przedsionków u pacjentów z wszczepionymi układami ICD i CRT-D wydaje się być istotna klinicznie. Analizy przeprowadzone pod tym kątem stanowią źródło dodatkowych informacji dotyczących tej grupy chorych, jak i samych urządzeń, jako relatywnie skutecznego narzędzia w wykrywaniu bezobjawowego migotania przedsionków. Jednocześnie pokazują ograniczenia metody oraz problemy, z jakimi może spotkać się osoba sprawująca kontrolę nad pacjentem ambulatoryjnym, który nie podlega rutynowej obserwacji metodą telemonitoringu.
26
2. CELE PRACY
Celami pracy było:
określenie częstości występowania migotania przedsionków u chorych z wszczepionymi urządzeniami do terapii wysokoenergetycznej;
określenie liczby epizodów objawowego i bezobjawowego migotania przedsionków; ocena skuteczności wykrywania migotania przedsionków w oparciu o analizę pamięci
w urządzeniach pracujących w różnych trybach stymulacji;
określenie czynników wpływających na ryzyko wystąpienia migotania przedsionków u chorych z wszczepionymi CIED (wszczepialne urządzenia do elektroterapii serca).
27
3. GRUPA BADANA
Zgodnie z protokołem badania, włączano do niego kolejnych chorych, aż do stwierdzenia w okresie obserwacji u co najmniej 50 badanych, wystąpienia napadu migotania przedsionków, w oparciu o analizę pamięci urządzeń i badanie kliniczne.
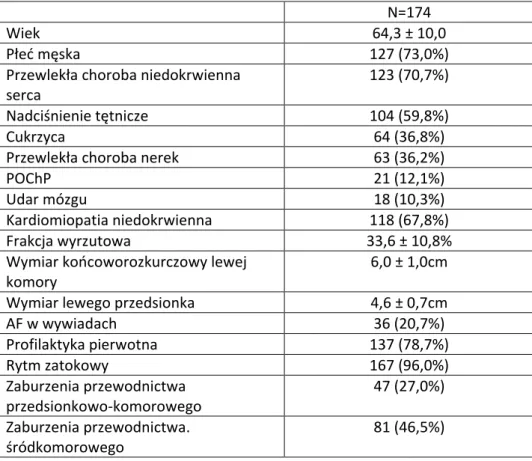
Do badania włączono 174 kolejnych pacjentów, obojga płci, w wieku od 18 do 85 lat, z niewydolnością serca w klasie czynnościowej I-IV˚ oraz ze wszczepionymi układami ICD-VR, -DR i CRT-D, którzy odbywali wizyty w Przyszpitalnej Poradni Kontroli Urządzeń pomiędzy 1.09.2014 a 30.04.2016. U 170 spośród nich, zabieg implantacji przeprowadzono w Wielospecjalistycznym Szpitalu Zespolonym w Nowej Soli, a u pozostałych 4 chorych w innych ośrodkach. Kryterium wykluczenia było obecne migotanie przedsionków w momencie włączania do badania. Analizie poddano wyniki uzyskane 901 wizyt kontrolnych. Każdy uczestnik badania, w trakcie rozmowy kwalifikacyjnej, został poinformowany o celach i metodach badania oraz wyraził pisemną zgodę na udział w nim. Każdy chory otrzymywał jeden egzemplarz świadomej zgody oraz pisemne informacje ogólne dotyczące udziału w badaniu.
28
4. METODYKA
Analizy parametrów klinicznych i zawartości pamięci urządzeń dokonano w czasie wizyt w Poradni, które odbywały się w okresach trzymiesięcznych (3, 6, 9, 12, 15, 18 miesiące ±1 miesiąc) począwszy od dnia włączenia do badania. U 19 chorych, których włączono do badania podczas leczenia szpitalnego, bezpośrednio po wszczepieniu urządzenia, czas od włączenia do badania do pierwszej wizyty był krótszy i wynosił zgodnie z zleceniami towarzystw naukowych od 4 do 12 tygodni. Bazę danych zamknięto w dniu 30.04.2016. W dniu 6.12.2015 u 50 pacjenta stwierdzono wystąpienie epizodu migotania/trzepotania przedsionków. Badanie przedłużono do dnia zamknięcia bazy danych w celu odbycia przez ostatniego włączonego chorego minimum jednej wizyty kontrolnej.
Za epizod migotania przedsionków uznano każde AF zanotowane w pamięci urządzenia trwające przynajmniej 30 sekund. Za objawowy epizod uznawano arytmię związaną z wyładowaniem, pogorszeniem wydolności serca, zasłabnięciem lub omdleniem, odczuwanym kołataniem serca, osłabieniem, bólem w klatce piersiowej bądź dusznością związaną z odczuciem nierytmicznej pracy serca. Za bezobjawowe uznawano pozostałe epizody.
Średnie obciążenie napadem migotania przedsionków w minutach na miesiąc tzw.
ładunek migotania przedsionków, otrzymano w wyniku podzielenia zsumowanego
całkowitego czasu trwania epizodów (w minutach) u indywidualnego chorego przez czas jego obserwacji (w miesiącach).
Natomiast mediana liczby epizodów na kwartał otrzymana została w wyniku podzielenia zsumowanej liczby wszystkich epizodów przez całkowity czas obserwacji chorego w kwartałach.
Podczas wizyty kwalifikacyjnej zbierano podstawowe dane demograficzne i kliniczne: wiek, płeć pacjenta, data wszczepienia i typ urządzenia, przeprowadzano ocenę klasy czynnościowej wydolności serca wg NYHA, gromadzono dane dotyczące dotychczasowego przebiegu choroby i schorzeń współistniejących: choroby wieńcowej (przebyty zawał serca, PTCA, CABG), nadciśnienia tętniczego, cukrzycy, POChP, przebytego udaru mózgu (w tym TIA), niewydolności nerek (podwyższone stężenie kreatyniny), etiologii niewydolności serca
29 (niedokrwienna i inna niż niedokrwienna ) oraz rodzaju wskazań do wszczepienia urządzenia (profilaktyka – pierwotna, wtórna). Na podstawie analizy dostępnej dokumentacji (karty informacyjne leczenia szpitalnego i na SOR, dokumentacja poradni kontroli urządzeń wszczepialnych) ustalano, czy chory w przeszłości doświadczył napadowego migotania przedsionków. Następnie przeprowadzano badanie fizykalne, dokonywano rejestracji spoczynkowego zapisu ekg oraz przeprowadzano kontrolę urządzenia (typ urządzenia, tryb stymulacji, % stymulacji poszczególnych jam serca), ocenę rytmu serca, obecności zaburzeń przewodzenia przedsionkowo-komorowego i śródkomorowego, oceniano szerokość zespołu QRS. W dniu włączenia do badania lub w ciągu najbliższych 2 tygodni dokonywano oceny podstawowych parametrów echokardiograficznych: wymiar lewego przedsionka, wymiar końcoworozkurczowy lewej komory, frakcja wyrzucania LV i wielkość fali zwrotnej mitralnej. Zbierano wywiad dotyczący aktualnie stosowanego leczenia farmakologicznego z uwzględnieniem: leków betadrenolitycznych (LBA), inhibitorów enzymu konwertującego angiotensynę (ACEI), antagonistów receptora angiotensyny (ARB), blokerów kanału wapniowego (CCB), diuretyków, digoksyny, amiodaronu, innych leków antyarytmicznych, leków hipolipemizujących, leków przeciwpłytkowych i przeciwkrzepliwych. Podczas kolejnych wizyt kontrolnych poddawano analizie rytm serca, tryb stymulacji, odsetek pobudzeń wystymulowanych (% stymulacji w poszczególnych jamach serca RA, RV, LV). Oceniano także klasę czynnościową wg NYHA. Analizowano pamięć urządzenia, wynik badania klinicznego i zgromadzoną między wizytami dokumentację medyczną w kierunku występowania epizodów migotania przedsionków. U pacjentów, u których w okresie obserwacji stwierdzono obecność tej arytmii, analizowano ją pod kątem występowania objawów z nią
związanych, liczbę epizodów, sumaryczny czas jej trwania, datę wystąpienia arytmii. W przypadku hospitalizacji w okresie między wizytami oceniano ich przyczynę: zawał serca,
udar mózgu, wymiana lub rozbudowa urządzenia, ablacja. Analizowano aktualną farmakoterapię z uwzględnieniem kontynuacji oraz ewentualne włączenie lub odstawienie leków przeciwkrzepliwych. Jeżeli w okresie obserwacji wystąpił zgon chorego, w oparciu o dostępne dane i informację rodziny ustalano jego przyczynę.
Kontroli urządzeń dokonywano (stosownie do rodzaju i typu wszczepionego defibrylatora) przy użyciu programatorów następujących firm: BIOTRONIK, MEDTRONIC,
30 urządzenia i zapisów elektrokardiogramów wewnątrzsercowych wykonywał lekarz wyszkolony w kontroli urządzeń do elektroterapii serca. Zapisy zdarzeń AT/AF były zawsze przez niego weryfikowane. Analizowane również były informacje dotyczące automatycznego trybu przełączania (Automatic Mode Switch– AMS), zapisy wysokiej częstotliwości epizodów przedsionkowych (Atrial High Rate Episodes AHRE). U chorych z kardiowerterami jednojamowymi, napady AF rozpoznawane były w oparciu o analizę pamięci urządzeń z zapisanymi szybkimi rytmami komorowymi w strefach VT/VF i „Monitor”. Za czas trwania epizodu AF u tych chorych przyjęto czas, w którym tachyarytmia utrzymywała się powyżej progu detekcji arytmii komorowej i została oceniona przez lekarza jako migotanie przedsionków.
Badanie echokardiograficzne wykonywano przy użyciu aparatu EPIC 7C firmy PHILIPS. Obrazy uzyskiwano z projekcji przymostkowej (w osi długiej i krótkiej ) i koniuszkowej (dwu- i czterojamowej). Wymiary lewego przedsionka i lewej komory, frakcji wyrzucania LV oraz niedomykalności mitralnej oceniano zgodnie ze standardowym protokołem:
wymiar lewej komory – pomiar liniowy w prezentacji dwuwymiarowej, w osi długiej projekcji przymostkowej, na poziomie nici ścięgnistych zastawki mitralnej – określano wymiar wewnętrzny lewej komory w skurczu i rozkurczu;
wymiar lewego przedsionka – pomiar liniowy w prezentacji dwuwymiarowej pod koniec skurczu LV, w projekcji przymostkowej w osi krótkiej i długiej oraz dwu- i czterojamowej- przy niejednoznacznym obrazie echokardiograficznym w projekcjach koniuszkowych;
objętość końcowoskurczowa (LVESV) i końcoworozkurczowa (LVEDV) lewej komory obliczano w oparciu o zmodyfikowaną metodę wg Simpsona (biplane Simpson's method) używając projekcji koniuszkowej dwu- i czterojamowej;57
stopień niedomykalności mitralnej oceniano zgodnie z zaleceniami European Association of Echocardiography i na podstawie wizualizacji z użyciem kolorowego dopplera oraz stosownie do zasięgu fali zwrotnej mitralnej klasyfikowano wg trzystopniowej skali: I° - łagodna, II °- umiarkowana, III° - duża (ciężka).58
31
Analiza statystyczna
Zmienne ilościowe podlegające rozkładowi normalnemu przedstawiono w postaci średnich arytmetycznych i odchyleń standardowych. Do oszacowania istotności różnic pomiędzy wartościami średnimi tych zmiennych zastosowano test T-Studenta, odpowiednio dla homogenicznej lub niehomogenicznej wariancji.
Zmienne ilościowe o nieregularnych rozkładach scharakteryzowano za pomocą mediany oraz zakresu interkwartylowego. Do weryfikacji jednorodności dystrybuant tych zmiennych zastosowano nieparametryczny test Manna-Whitney’a.
Zmienne nominalne przedstawiono w postaci częstości bezwzględnej oraz częstości względnej (%) wyróżnionych wariantów cechy. Istotność różnic pomiędzy frakcjami zmiennych różnych grup oszacowano testem chi2, z poprawką na ciągłość Yates’a lub dokładnym testem Fishera.
Zmiany prawdopodobieństwa przeżycia bez napadu migotania przedsionków w funkcji czasu badanej grupy chorych wyznaczono metodą limitu iloczynowego Kaplana-Meiera. Jednorodność krzywych otrzymanych dla różnych podpopulacji porównywano testem log-rank, z testem po fakcie Tukey’a w przypadku porównań wielokrotnych (par krzywych).
Do wskazania niezależnych predyktorów napadu migotania przedsionków wykorzystano wielowymiarową analizę proporcjonalnego hazardu Coxa, po zweryfikowaniu założeń umożliwiających wykonanie analizy. Wyniki przedstawiono w postaci współczynników hazardu wraz 95% przedziałami ufności.
Do wskazania niezależnych predyktorów zgonu wykorzystano jedno- i wielowymiarową analizę regresji logistycznej. Selekcji zmiennych dokonano metodą krokową wsteczną. Wyniki przedstawiono w postaci ilorazów szans wraz 95% przedziałami ufności.
Dwustronne hipotezy zerowe weryfikowano na poziomie istotności statystycznej p<0,05. Analiza statystyczna przeprowadzona została z wykorzystaniem pakietu SAS 9.2.
Badanie uzyskało zgodę Komisji Bioetycznej przy Uniwersytecie Medycznym im. Karola Marcinkowskiego w Poznaniu, nr 601/14 z dnia 12.06.2014 r.
32
5. WYNIKI
5.1 Harmonogram rekrutacji chorych
Do badania, które trwało od 1.09.2014 do 30.04.2016 (20 miesięcy) włączono 174 pacjentów. Uczestnicy badania odbyli łącznie 901 wizyt. Na rycinie 1 przedstawiono postęp włączania kolejnych chorych do badania oraz narastająco liczbę chorych, u których stwierdzono napad migotania przedsionków w okresie obserwacji.
Na rycinie 2 przedstawiono liczby chorych w kolejnych fazach badania (kolejne wizyty kontrolne, zgony, wystąpienie napadu migotania przedsionków (flow chart).
Średni czas jaki upłynął od implantacji urządzenia do włączenia chorego do programu wynosił 1018 ± 684 dni ( od 2,8 ± 2,4 lat).
-5 15 35 55 75 95 115 135 155 175 0 50 100 150 200 250 300 350 400 450 500 Rekrutacja pacjentów Pierwsze epizody AF
Czas od rozpoczęcia programu [dni]
33 Dwie osoby zmarły przed upływem 3 miesięcy od włączenia do badania, w tym jedna, która odbyła wizytę po 1 miesiącu od włączenia i jedna, która nie odbyła żadnej wizyty (ta ostatnia została wyłączona z późniejszych analiz). Tak więc do ostatecznej analizy włączono 173 chorych, którzy odbyli minimum jedną wizytę kontrolną.
5.2 Charakterystyka chorych włączonych do programu
5.2.1 Charakterystyka demograficzna i kliniczna
Charakterystykę badanych osób przedstawiono w tabeli 1.
Średni wiek chorych włączonych do programu wynosił 64,3 ± 10,0 lat. Zdecydowaną większość stanowili mężczyźni (127 osób, 73.4%), kobiety (47 osób, 26,6%).
Baseline
3 miesiące
6 miesięcy
9 miesięcy
12 miesięcy
Zakończenie obserwacji: n=7 Zakończenie obserwacji: n=12N=171
N=172
N=160
N=174
N=147
Zgon: n=2 Zgon: n=1 Zgon: n=4 Zgon: n=115 miesięcy
70
Zakończenie obserwacji: n=69 n=14 n=14 n=10 n=7 Zgon: n=1Liczba chorych, u których wystąpił pierwszy epizod FA podczas obserwacji
15 miesięcy
77
n=934 U znacznego odsetka pacjentów uczestniczących w badaniu występowała choroba wieńcowa (70,7%) i nadciśnienie tętnicze (59,8%), rzadziej w wywiadach stwierdzano niewydolność nerek (36,2%), cukrzycę (36,8%) i POChP (12,1%).
U 36 pacjentów (20,7%) napady migotania przedsionków występowały już w przeszłości. Wywiad przebytego udaru mózgu miało 18 osób (10,3%), w tej grupie chorych wywiad w kierunku napadowego migotania przedsionków miały 2 osoby (stanowi to 11% osób z niedokrwieniem mózgu w wywiadzie).
Tabela 1. Charakterystyka osób włączonych do programu.
N=174
Wiek 64,3 ± 10,0
Płeć męska 127 (73,0%)
Przewlekła choroba niedokrwienna serca
123 (70,7%) Nadciśnienie tętnicze 104 (59,8%)
Cukrzyca 64 (36,8%)
Przewlekła choroba nerek 63 (36,2%)
POChP 21 (12,1%)
Udar mózgu 18 (10,3%)
Kardiomiopatia niedokrwienna 118 (67,8%) Frakcja wyrzutowa 33,6 ± 10,8% Wymiar końcoworozkurczowy lewej
komory
6,0 ± 1,0cm Wymiar lewego przedsionka 4,6 ± 0,7cm
AF w wywiadach 36 (20,7%) Profilaktyka pierwotna 137 (78,7%) Rytm zatokowy 167 (96,0%) Zaburzenia przewodnictwa przedsionkowo-komorowego 47 (27,0%) Zaburzenia przewodnictwa. śródkomorowego 81 (46,5%)
W przeważającej liczbie – 136 chorych (78,6%) wszczepiono układ defibrylujący w profilaktyce pierwotnej. Profilaktyka wtórna była powodem wszczepienia ICD/CRT-D u 38 pacjentów (31,4%).
166 pacjentów (96%) miało rytm zatokowy, pozostali – 8 osób (4%) - wystymulowany.
Ponad ¼ chorych - 47 osób (27,2%) miała zaburzenia przewodnictwa przedsionkowo- komorowego pod postacią bloku I – III°, a 81 chorych (46,8%) zaburzenia przewodnictwa śródkomorowego (LBBB lub RBBB).
35 Etiologia niedokrwienna występowała najczęściej w grupie obserwowanej stanowiąc przyczynę 67,8% niewydolności serca. Średnia frakcja wyrzucania LV w badanej grupie wynosiła 33,6 ± 10,8%, wymiar końcoworozkurczowy lewej komory wynosił przeciętnie 60 ± 10mm, a średni wymiar lewego przedsionka 46 ± 7mm.
5.2.2 Typ wszczepionego urządzenia i obciążenie stymulacją
Najliczniejszą grupę obserwowanych stanowili chorzy z wszczepionym jednojamowym kardiowerterem-defibrylatorem (ICD-VR). Było ich w badaniu 93, co stanowi 53,5% wszystkich włączonych do obserwacji. Druga liczebnie grupa obejmowała 50 chorych (29,3%,) z implantowanym układem resynchronizującym z funkcją defibrylacji CRT-D – trzecia - 30 chorych (17,2%) z dwujamowym kardiowerterem-defibrylatorem ICD-DR (rycina 3).
36 Przeciętne wielkości obciążenia stymulacją prawego przedsionka i prawej komory oraz lewej komory , wyliczone dla całego okresu obserwacji przedstawiono w tabeli 2.
Tabela 2. Obciążenie stymulacją prawego przedsionka, prawej komory i lewej komory w okresie obserwacji.
Stymulacja RA Stymulacja RV Stymulacja LV
ICD-VR - 0 [ 0 – 0]**, max: 99,3
-ICD-DR 55,7 [15,6–70,0], max: 93,5 34,7 [ 1,43–92,0], max:100
-CRT-D 33,8 [ 14,6–58,0], max: 98,0 98,6 [96.0-99,7], max:100 98,7 [96-99,7]; max:100 * mediana , zakres interkwartylowy
** Obciążenie stymulacją u 80 chorych z wszczepionym układem VVI RV w całym okresie obserwacji wynosiło 0. Mediana i zakres interkwartylowy stymulacji RV w grupie pozostałych 13 osób z VVI wynosiły: 7,8 [1,0-74,8%].
5.3 Charakterystyka napadów migotań przedsionków występujących w grupie badanych chorych
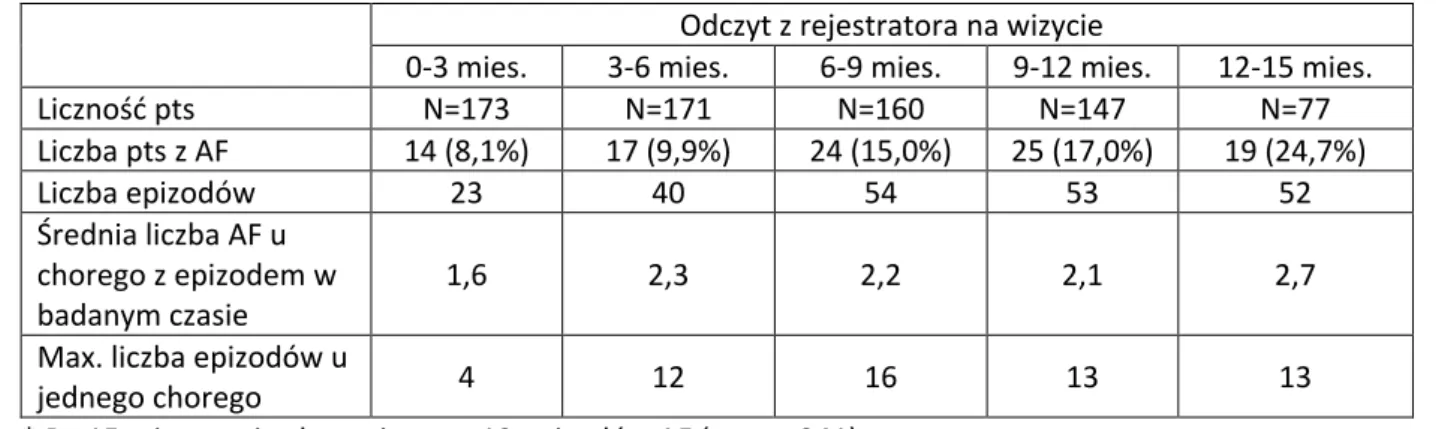
Wzrost prawdopodobieństwa wystąpienia napadu migotania przedsionków w badanej populacji chorych wraz z czasem obserwacji przedstawiono na rycinie 4.
Estymacja metodą Kaplana-Meiera wykazała, że prawdopodobieństwo wystąpienia tego incydentu w ciągu trzech, sześciu, dziewięciu, dwunastu oraz piętnastu miesięcy wynosi odpowiednio: 0,08 , 0,16, 0,18, 0,26 oraz 0,36. W pełnym 20-miesięcznym okresie obserwacji prawdopodobieństwo to osiągnęło 0,38.