KLINIKA PERINATOLOGII I CHORÓB KOBIECYCH
UNIWERSYTET MEDYCZNY IM. KAROLA MARCINKOWSKIEGO
W POZNANIUZ
NACZENIE TROMBOFILII WRODZONEJ W ETIOLOGII
NAWRACAJĄCYCH NIEPOWODZEŃ POŁOŻNICZYCH
DR N. MED. HUBERT WOLSKI
SPIS TREŚCI
WYKAZ STOSOWANYCH SKRÓTÓW
WSTĘP
KLASYFIKACJA NAWRACAJĄCYCH UTRAT CIĄŻ
EPIDEMIOLOGIA PORONIEŃ NAWRACAJĄCYCH I ZGONÓW WEWNĄTRZMACICZNYCH NAWRACAJĄCE UTRATY CIĄŻ JAKO PROBLEM PSYCHOLOGICZNY I SPOŁECZNY ETIOLOGIA PORONIEŃ NAWRACAJĄCYCH I ZGONÓW WEWNĄTRZMACICZNYCH POLIMORFIZMY UKŁADU KRZEPNIĘCIA I FIBRYNOLIZY
TROMBOFILA WRODZONA JAKO PRZYCZYNA NAWRACAJĄCYCH UTRAT CIĄŻ CZYNNIK V KRZEPNIĘCIA – POLIMORFIZM 1691G>A ORAZ 1328C>T CZYNNIK II KRZEPNIĘCIA – POLIMORFIZM 20210G>A
CZYNNIK VII KRZEPNIĘCIA – POLIMORFIZM R353Q
REDUKTAZA METYLENOTETRAHYDROFOLIANOWA – POLIMORFIZM 677C>T,1298A>C, 1793G>A
PODSUMOWANIE
CEL PRACY
MATERIAŁ I METODY
CHARAKTERYSTYKA BADANYCH GRUP METODYKA
IZOLACJA GENOMOWEGO DNA OZNACZANIE JAKOŚCI I ILOŚCI DNA REAKCJA PCR/RFLP
APARATURA ZASTOSOWANA W PRACY
METODY STATYSTYCZNE STOSOWANE W PRACY
WYNIKI
ANALIZA DANYCH KLINICZNYCH W BADANYCH GRUPACH KOBIET ANALIZA WYNIKÓW BADAŃ GENETYCZNYCH
POLIMORFIZM 1691G>A GENU CZYNNIKA V KRZEPNIĘCIA POLIMORFIZM M385T GENU CZYNNIKA V KRZEPNIĘCIA POLIMORFIZM 20210G>A GENU PROTROMBINY
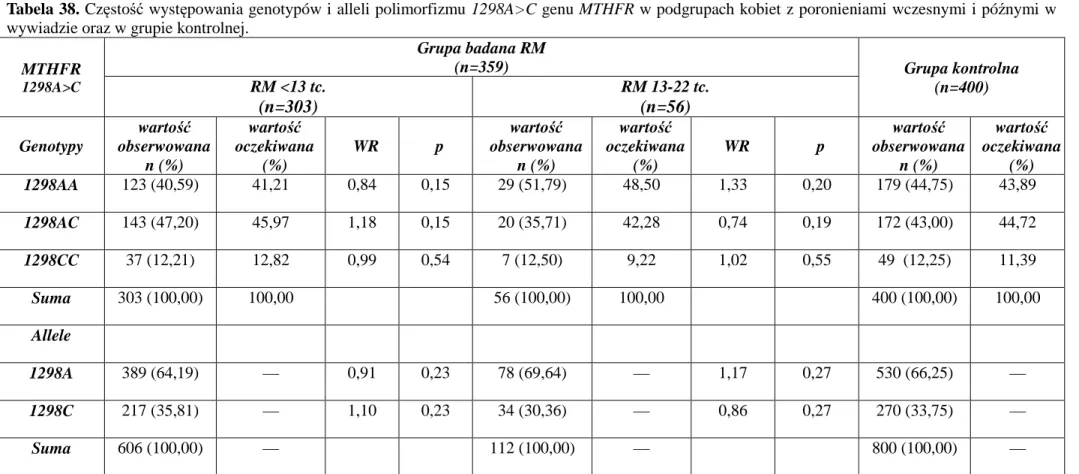
POLIMORFIZM R353Q (11496G>A) GENU CZYNNIKA VII KRZEPNIĘCIA POLIMORFIZM 677C>T GENU MTHFR
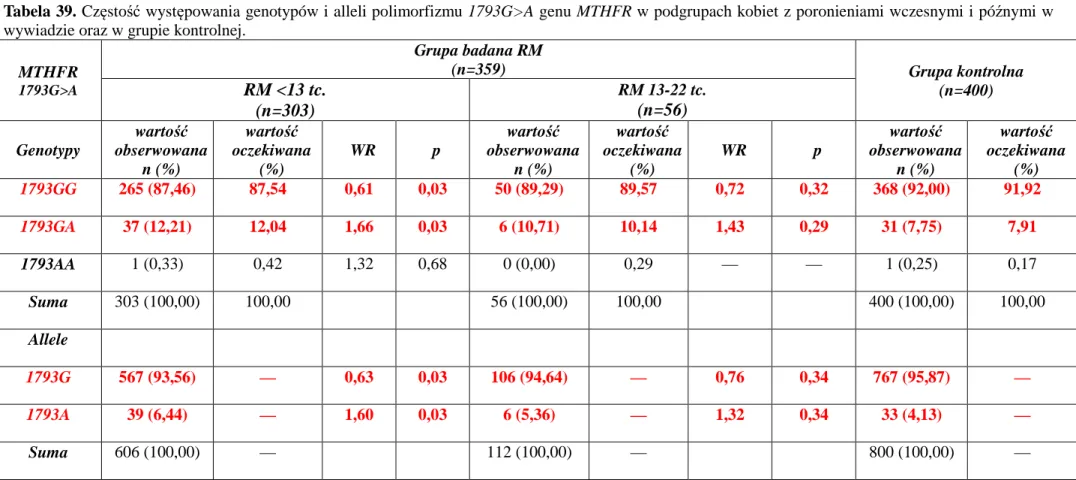
POLIMORFIZM 1298A>C GENU MTHFR POLIMORFIZM 1793G>A GENU MTHFR
ANALIZA PORÓWNAWCZA GENOTYPÓW I ALLELI BADANYCH POLIMORFIZMÓW W ZALEŻNOŚCI OD LICZBY PORONIEŃ W WYWIADZIE
ANALIZA PORÓWNAWCZA GENOTYPÓW I ALLELI BADANYCH POLIMORFIZMÓW W PODGRUPACH WYODRĘBNIONYCH W ZALEŻNOŚCI OD CZASU WYSTĄPIENIA PORONIEŃ NAWRACAJĄCYCH WSPÓŁWYSTĘPOWANIE GENOTYPÓW ANALIZOWANYCH W PRACY POLIMORFIZMÓW ANALIZA HAPLOTYPÓW GENU CZYNNIKA V KRZEPNIĘCIA FV ORAZ GENU MTHFR ANALIZA HAPLOTYPÓW GENU CZYNNIKA V KRZEPNIĘCIA
ANALIZA HAPLOTYPÓW GENU MTHFR
SUMARYCZNA ANALIZA WYSTĘPOWANIA CZYNNIKÓW RYZYKA TROMBOFILII WRODZONEJ W BADANYCH GRUPACH KOBIET Z RPL
ANALIZA DANYCH KLINICZNYCH PACJENTEK W ZALEŻNOŚCI OD POSZCZEGÓLNYCH GENOTYPÓW BADANYCH W PRACY POLIMORFIZMÓW
DYSKUSJA
UDZIAŁ POLIMORFIZMÓW PROZAKRZEPOWYCH W ETIOLOGII PORONIEŃ NAWRACAJĄCYCH POLIMORFIZM 1691G>A ORAZ POLIMORFIZMU 1328T>C GENU CZYNNIKA V KRZEPNIĘCIA POLIMORFIZM 20210G>A GENU II CZYNNIKA KRZEPNIĘCIA
POLIMORFIZM R353Q GENU CZYNNIKA VII KRZEPNIĘCIA
POLIMORFIZM 677C>T,1298A>C ORAZ 1793G>A GENU MTHFR W ETIOLOGII RM
INNE POLIMORFIZMY KASKADY KRZEPNIĘCIA I FIBRYNOLIZY A ETIOLOGIA PORONIEŃ NAWRACAJĄCYCH
ZNACZENIE TROMBOFILII WRODZONEJ W ETIOLOGII IUFD INNE POLIMORFIZMY A ETIOLOGIA IUFD
POLECANE TESTY W DIAGNOSTYCE TROMBOFILII
PROFILAKTYKA PRZECIWZAKRZEPOWA U KOBIET Z NAWRACAJĄCYMI UTRATAMI CIĄŻY
POSTĘPOWANIE W PRZYPADKU WYWIADU OBCIĄŻONEGO WYSTĘPOWANIEM NAWRACAJĄCYCH NIEPOWODZEŃ POŁOŻNICZYCH
ANALIZA WSPÓŁWYSTĘPOWANIA GENOTYPÓW ORAZ HAPLOTYPÓW BADANYCH POLIMORFIZMÓW
OGRANICZENIA WYNIKAJĄCE Z PRZEPROWADZANYCH BADAŃ PODSUMOWANIE PRZEPROWADZONYCH BADAŃ
WNIOSKI
PIŚMIENNICTWO
STRESZCZENIE W J. POLSKIM
STRESZCZENIE W J. ANGIELSKIM
SPIS TABEL, RYCIN I FOTOGRAFII
APPENDIX
WYKAZ STOSOWANYCH SKRÓTÓW
aCL przeciwciała antykardiolipinowe (ang. anticardiolipin antibodies)
ACMG Amerykańskie Towarzystwo Genetyki Medycznej (ang. American College of Medical Genetics)
ACOG Amerykańskie Towarzystwo Położników i Ginekologów (ang. American College of Obstetricians and Gynecologists)
APL przeciwciała antyfosfolipidowe (ang. antiphospholipid antibodies) ASA kwas acetylosalicylowy (ang. acetylosalicylic acid)
APC aktywowane białko C (ang. activated protein C)
APCR oporność na aktywowane białko C (ang. activated protein C resistance) APS zespół antyfosfolipidowy (ang. antiphospholipid syndrome)
β2-GPI beta2-glikoproteina I (ang. β2-glycoprotein I) BMI wskaźnik masy ciała (ang. body mass index)
CNV wariacje liczby powtórzeń (ang. copy number variations) CRL długość ciemieniowo-siedzeniowa (ang- crown- rump length) CBS β-syntaza cysteationiny (ang. cystathionine β-synthase)
CYP450 rodzina cytochrome CYP450 (P450) (ang. cytochrome 450 family) D współczynnik nierównowagi sprzężeń (ang. deviation)
DNA kwas dezoksyrybonukleinowy (ang. deoxyribonucleic acid)
EDTA kwas etylenodiaminotetraoctowy (ang. ethylene diamine tetraacetic acid) eNOS endotelialna syntaza NO (ang. endothelial nitric oxide synthase)
ESHRE Europejskie Towarzystwo Rozrodu Człowieka i Embriologii (ang. European Society of Human Reproduction and Embryology)
F czynnik krzepnięcia (ang. coagulation factor)
FAD dinukleotyd flawinoadeninowy (ang.flavin adenine dinucleotide)
FDP produkty degradacji fibrynogenu/ fibryny (ang. fibryn degradation products) FVL mutacja 1691G>A czynnika V (Leiden) (ang. factor V Leiden)
GSTA1 glutation-S-transferaza alfa 1 (ang. glutatione S-transferase) Hcy homocysteina (ang. homocysteine)
HELLP anemia hemolityczna, podwyższenie enzymów wątrobowych, obniżenie liczby płytek (ang. hemolytic anemia, elevated liver enzymes, low platelet count) HHcy hiperhomocysteinemia (ang. hyperhomocysteinemia)
ICSI metoda wprowadzenia plemnika do cytoplazmy komórki jajowej (ang. intra cytoplsmatic sperm iniection)
IL-1ra antagonista receptora interleukiny 1 (ang. interleukin 1 receptor antagonist) IUFD zgon wewnątrzmaciczny (ang. intrauterine fetal death)
IUGR wewnątrzmaciczne ograniczenie wzrastania płodu (ang. intrauterine growth retardation)
LA antykoagulant toczniowy (ang. lupus anticoagulant, lupus antibodies) LD nierównowaga sprzężeń (ang. linkage disequilibrium)
LMWH heparyna drobnocząsteczkowa (ang. low molecular weight heparin) LOD logarytm szans (ang. logarithm of the likelihood odds ratio)
MTHFR reduktaza 5,10-metylenotetrahydrofolianowa (ang.
mRNA matrycowy RNA (ang. messanger RNA)
NADPH dinukleotyd nikotynoamidoadeninowy (ang. nicotinamide adenine dinucleotide phosphate)
NAT2 N-acetylotransferaza 2 (ang. N-acetylotransferase 2) OD gęstość optyczna (ang. optical density)
PAI-1 inhibitor fibrynolizy typu-1 (ang. plasminogen activator inhibitor type-1) PCR polimerazowa reakcja łańcuchowa (ang. polymerase chain reaction) PE stan przedrzucawkowy (ang. preeclampsia)
PGF łożyskowy czynnik wzrostu (ang. placental growth factor) Prou-PA prourokinaza (ang. prourokinase)
PSANZ Australijskie i Nowozelandzkie Towarzystwo Medycyny Perinatalnej (ang. Perinatal Society of Australia and New Zealand)
PSANZ-PDC klasyfikacja zgonów perinatalnych wg Australijskiego i Nowozelandzkiego Towarzystwa Medycyny Perinatalnej ( ang. Perinatal Society of Australia and New Zealand - Perinatal Death Classification)
PTM mutacja 20210G>A genu protrombiny (ang. prothrombin mutation) PTSD zespół stresu pourazowego (ang. posttraumatic stress disorder) pz par zasad (ang. base pair, bp)
RFLP polimorfizm długości fragmentów restrykcyjnych (ang. restriction fragments length polymorphism)
RM poronienia nawracające (ang. recurrent miscarriage) RPL nawracające utraty ciąż (ang. recurrent pregnancy loss) SAM S-adenozylometionina (ang. S-adenosylmethionine) SAH S-adenozylhomocysteina (ang. S-adenosylhomocysteine)
SNP polimorfizm pojedynczego nukleotydu (ang. single nucleotide polymorphism) TAFI inhibitor fibrynolizy aktywowany trombiną (ang. thrombin activated
fibrinolysis inhibitor)
tPA tkankowy aktywator plazminogenu (ang. tissue plasminogen activator) u-PA urokinazowy aktywator plazminogenu (ang. plasminogen activator urokinase) UTR nietranslowane sekwencje w mRNA (ang. untranslated region)
VTE żylna choroba zakrzepowo- zatorowa (ang. venous thromboembolism) WHO Światowa Organizacja Zdrowia (ang. World Health Organization) WR współczynnik ryzyka, iloraz szans (ang. odds ratio)
WSTĘP
Od dawno podkreśla się, jak bardzo znaczącym i trudnym problemem w medycynie perinatalnej jest niemożność zajścia w ciążę, jak również niemożność jej donoszenia. Niepłodność dotyczy około 15% związków partnerskich w wieku rozrodczym. Współcześnie według Sekcji Płodności i Niepłodności Polskiego Towarzystwa Ginekologicznego oraz Europejskiego Towarzystwa Rozrodu Człowieka i Embriologii szacuje się, że niepłodność w Polsce obejmuje nawet około 1,2 do 1,5 miliona par.
Z drugiej strony nie mniejszym problemem jest niemożność donoszenia ciąży, która dotyczy nawet kilkunastu procent kobiet i obejmuje poronienia samoistne, poronienia nawracające i zgony wewnątrzmaciczne w II połowie ciąży. Właściwa diagnostyka nawracających utrat ciąż jest trudnym wyzwaniem dla każdego lekarza ginekologa. Z jednej strony etiologia tych powikłań w większości przypadków pozostaje niewyjaśniona, z drugiej rezultaty wynikające z zastosowanych metod diagnostycznych i leczniczych często pozostają niezadawalające. Duża liczba osób pozostających w związku partnerskim, zarówno kobiet, jak i mężczyzn doświadczających utraty ciąży wymaga niejednokrotnie zastosowania wielu kompleksowych badań i algorytmów postępowania medycznego, jak również specjalnej opieki psychologicznej. Ze względu na rangę problemu w poznaniu etiopatogenezy tych powikłań zastosowanie znajdują coraz coraz nowocześniejsze metody diagnostyczne mające wskazać możliwe przyczyny występowania nawracających utrat ciąż.
Wiele metod z zakresu biologii molekularnej znalazło zastosowanie również w diagnostyce nawracających utrat ciąż. Jedną z nich jest określenie znaczenia polimorfizmów genów kandydujących, które włączone w szlaki przemian biochemicznych, enzymatycznych i hormonalnych mają istotny udział w patomechanizmie niepowodzeń w ciąży. Badanie polimorfizmów genetycznych może zostać również wykorzystane do wyznaczania nowych markerów ryzyka wystąpienia poronień nawracających i zgonów wewnątrzmacicznych. Stąd coraz więcej badań bezpośrednio bada związek polimorfizmów genetycznych z występowaniem nawracających utrat ciąż (RPL – recurrent pregnancy loss).
Wydaje się, że w wielu patologiach dotyczących ciąży ważną rolę odgrywa nadmierna aktywacja procesu wykrzepiania wewnątrznaczyniowego w krążeniu maciczno-łożyskowym,
szczególnie nasilona u kobiet z trombofilią wrodzoną i nabytą. Wiele badań wskazuje na udział wrodzonej trombofilii w etiologii stanu przedrzucawkowego i rzucawki, przedwczesnego oddzielenia łożyska, ograniczenia wewnątrzmacicznego wzrastania płodu oraz żylnej choroby zakrzepowo-zatorowej. W ostatnich latach analizuje się również udział trombofilii wrodzonej w etiopatogenezie poronień nawracających i zgonu wewnątrzmacicznego płodu w późnym okresie ciąży [Mousa i wsp., 2001, Adelberg i wsp., 2002, Alfirevic i wsp., 2002, Krabbendam i wsp., 2005, Kutteh i wsp., 2006].
KLASYFIKACJA NAWRACAJĄCYCH UTRAT CIĄŻ
Poronienia nawracające (RM – reccurrent miscarriages) to trzy lub więcej następujących po sobie utrat ciąż przed 22 tygodniem czasu jej trwania. Wyklucza się tutaj ciążę biochemiczną, zaśniadową oraz ektopową. Poronienia nawracające mogą wystąpić z lub bez wcześniej zaistniałej ciąży zakończonej urodzeniem żywego dziecka. Definicję taką przyjęła Światowa Organizacja Zdrowia (WHO – World Health Organization) oraz Europejskie Towarzystwo Rozrodu Człowieka i Embriologii (ESHRE – European Society of Human Reproduction and Embryology). Przedstawiane przez szereg organizacji polskich i
śwatowych rekomendacje wskazują, że kobiety po trzech i więcej poronieniach należy objąć poszerzoną diagnostyką w kierunku ustalenia przyczyn występujących niepowodzeń. Zalecenia Polskiego Towarzystwa Ginekologicznego proponują jednak objęcie szczególną opieką kobiet już z dwoma następującymi po sobie poronieniami w wywiadzie (utraty ciąż <22 tc.) [Rekomendacje Polskiego Towarzystwa Ginekologicznego, 2008].
Poronienie biochemiczne to utrata ciąży, która potwierdzona został poprzez pozytywny wynik poziomu hormonu beta-hCG w moczu kobiety lub podwyższonego poziomu beta-hCG w surowicy krwi przed potwierdzeniem ultrasonograficznym i histopatologicznym. Poronienie takie najczęściej ma miejsce przed 6 tygodniem ciąży.
Ciąża zaśniadowa powstaje w wyniku nieprawidłowości w procesie zapłodnienia, w wyniku czego dochodzi do nieprawidłowego rozwoju łożyska i płodu (zaśniad niecałkowity) lub szybkiego intensywnego rozwoju tylko nieprawidłowego łożyska (zaśniad całokowity). Ciąża ektopowa rozwija się poza jamą macicy (najczęściej w bańce jajowodu, w dalszej
sytuacjach po rozpoznaniu wdraża się postępowanie terapeutyczne prowadzące do zakończenia ciąży.
Poronieniem klinicznym określamy sytuację, kiedy nastąpiło zakończenie ciąży po potwierdzeniu ultrasonograficznym i histopatologicznym jej zaistnienia. Poronienia kliniczne można podzielić na wczesne, przed <13 tc. oraz późne pomiędzy 13-22 tc. czasu trwania ciąży. Te właśnie poronienia, w momencie powtarzania się powikłania podlegają klasyfikacji jako nawracające lub nawykowe i podlegają wielokierunkowej rozszerzonej diagnostyce.
Późnym obumarciem wewnątrzmacicznym lub wewnątrzmacicznym zgonem płodu (IUFD – intrauterine fetal death) określamy zgon płodu przed jego urodzeniem, który nastąpił w okresie od 22 tc. do końca czasu trwania ciąży. Inna definicja określa zgon wewnątrzmaciczny jako martwe urodzenie płodu z masą co najmniej 500 g. Również w przypadku tego powikłania w przebiegu ciąży należy wdrożyć szczegółowa diagnostykę przyczyn jego wystąpienia.
EPIDEMIOLOGIA PORONIEŃ NAWRACAJĄCYCH I ZGONÓW WEWNĄTRZMACICZNYCH
Poronienia nawracające
Ocenia się, że nawet około 60-70% ciąż ulega samoistnemu poronieniu już na wstępnej fazie rozwoju zarodkowego (około 30-35% zarodków jest utraconych przed implantacją, a następne 30-35% tuż po implantacji ale przed terminem spodziewanej miesiączki). Dodatkowe 15% stanowią wczesne poronienia kliniczne, ale tu pojawiają się różnice w zależności od wieku kobiety. W licznych badaniach udokumentowano związek poronień z zaawansowanym wiekiem matki [Sauer i wsp., 2015]. Częstość występowania poronień wczesnych do 12+6 tc. szacowana jest na 10% w wieku 20-24 lata oraz nawet na 51% u kobiet w wieku 40-44 lata [Ticconi i wsp., 2015]. Późne poronienia od 13 do 22 tc. zdarzają się rzadziej i w całości populacji częstość ich występowania ocenia się na kilka procent.
Malformacje płodu obserwowane są w około 85% przypadków wczesnych klinicznych poronień. W tej grupie u 75% płodów obserwuje się nieprawidłowy kariotyp płodu, najczęściej aneuploidie chromosomalne [Saravelos i wsp., 2014].
U większości kobiet poronienia nawracające występują we wczesnym okresie ciąży, z czego znaczna część spowodowana jest obecnością aneuploidii chromosomowych. Aberracje
chromosomowe u płodów opisywane są w dużej grupie 29-60% kobiet z poronieniami nawracającymi. Znacznie mniejszy procent kobiet doświadcza poronień nawracających w późniejszym okresie ciąży. Poronienia te są w znacznie mniejszym stopniu związane z aberracjami chromosomowymi, a częściej spowodowane innymi przyczynami niż genetyczne. Ciekawą obserwacją jest występowanie poronień nawracających u tej samej kobiety w podobnym wieku ciążowym [Saito, 2009].
U 90% kobiet, które doświadczyły jednego poronienia następna ciąża kończy się urodzeniem zdrowego donoszonego noworodka. Dodatkowo pierwiastki i kobiety, u których wcześniejsza ciąża zakończyła się urodzeniem żywego dziecka mają mniejsze szanse na wystąpienie poronienia w następnej ciąży w porównaniu do kobiet, u których wcześniejsza ciąża zakończyła się poronieniem [Saito, 2009].
Około 5% par starających się o ciążę doświadcza dwóch następujących po sobie poronień, a około 1% par – trzech lub więcej następujących po sobie utrat ciąż. Po 2 następujących po sobie poronieniach 50-60% kobiet rodzi zdrowe donoszone dziecko. Po 3 następujących po sobie poronieniach szansa na następne niepowodzenie wynosi aż 45-50% i również zwiększa się wraz z wiekiem matki [Saito, 2009, Sauer i wsp., 2015].
Zgony wewnątrzmaciczne
Dane pochodzące z 2006 roku przedstawione przez National Vital Statistics Report w USA szacują częstość występowania późnych utrat ciąż na 6,05/1000 urodzeń, przy czym jest to wartość o 3% niższa w porównaniu do roku 2005 roku [MacDorman i wsp., 2012]. W skali światowej częstość ta różni się w zależności od jakości opieki zdrowotnej oraz definicji zgonu wewnątrzmacicznego w II i III trymestrze ciąży. Powszechne jest niedoszacowanie tego powikłania położniczego w krajach rozwijających się, co dodatkowo utrudnia przedstawienie rzetelnych ogólnoświatowych statystyk. W 2006 roku przypuszczalna ogólnoświatowa liczba późnych utrat ciąż wyniosła około 2,64 miliona (od 2,14 do 3,82 miliona). Szacuje się, że w okresie od 1995 roku do 2009 roku nastąpił spadek częstości zgonów wewnątrzmacicznych aż o 14,5%, co prawdopodobnie jest wynikiem poprawy standardów jakości opieki perinatalnej w krajach rozwiniętych [Cousens i wsp., 2011].
W podsumowaniu Lamont i wsp. na podstawie przeglądu baz Embase, Medline, Cochrane Library, PubMed, CINAHL, Scopus wyznaczono ryzyko wystąpienia IUFD w
urodzenie martwego płodu z masą co najmniej 400 g. Uzyskano dane dotyczące 3 412 079 kobiet z czego u 3 387 538 (99,3%) kobiet odnotowano wcześniej urodzenie żywego noworodka, natomiast u 24 541 (0,7%) kobiet odnotowano urodzenie martwe. W porównaniu do kobiet, które urodziły żywe dziecko z pierwszej ciąży, te kobiety, które doświadczyły IUFD w pierwszej ciąży miały 5 razy wyższe ryzyko ponownego wystąpienia IUFD w drugiej ciąży (WR=4,77). Ta duża analiza pokazuje, że ryzyko IUFD w następnej ciąży jest zdecydowanie wyższe u kobiet, które doświadczyły IUFD już w pierwszej ciąży [Lamont i wsp., 2015].
NAWRACAJĄCE UTRATY CIĄŻ JAKO PROBLEM PSYCHOLOGICZNY I SPOŁECZNY
Pod pojęciem utraty ciąży rozumie się wystąpienie poronienia samoistnego, indukowanego, poronień nawracających oraz zgonu wewnątrzmacicznego. Niewątpliwie każde z tych zdarzeń jest traumatycznym przeżyciem dla obojga parterów. Szczególnie powtarzające się utraty ciąż stanowią istotny problem medyczny i psychospołeczny. Problem ten dotyczy według niektórych statystyk nawet kilkunastu procent kobiet i ich partnerów. Stąd uważa się, obydwoje partnerzy powinny zostać objęci kompleksową opieką medyczną i psychologiczną [Kolte i wsp., 2015].
W przeprowadzonych badaniach ocenia się, że nawet 20% kobiet, które doświadczyły utraty ciąży cierpi z powodu długoterminowych skutków psychicznych, jak stany lękowe czy depresja. Najsilniejszym z tych skutków jest zespół stresu pourazowego (PTSD – posttraumatic stress disorder), który jest zaburzeniem lękowym wywołującym stres o znacznym nasileniu często po długim okresie utajenia (kilka tygodni lub miesięcy). Zespół PTSD, najczęściej o zmiennym przebiegu, może w rzadkich przypadkach prowadzić nawet do trwałych zmian osobowości u pacjentki [Craig, 2001, Li i wsp., 2012, Kolte i wsp., 2015].
Najczęściej u kobiet po utracie ciąży istnieje potrzeba udzielenia rutynowej pomocy psychologicznej bezpośrednio po zdarzeniu. W trudniejszych przypadkach czasookres udzielanej pomocy i utrzymanie kontaktu z zespołem doświadczonych psychologów klinicznych może ulec wydłużeniu i jest różny w indywidualnych przypadkach. Obok pomocy psychologicznej w ostrych przypadkach kryzysu psychicznego bezpośrednio po utracie ciąży, należy zwrócić również uwagę na wskazanie grupy kobiet, u których z powodów pewnych uwarunkowań (brak wsparcia partnera i rodziny, zaburzenia osobowości, wcześniejsze nerwice) wzrasta ryzyko narastania problemów psychicznych w późniejszym
okresie po utracie ciąży. Szczególną sytuacją są poronienia nawracające i zgony wewnątrzmaciczne w póżnej ciąży ujawniające doświadczenie utraty u obojga partnerów, czasem również uczucia osierocenia, szczególnie w przypadkach kiedy partnerzy nie mają dzieci. Okoliczności takie prowadzą do nałożenia się elementów reakcji psychologicznej i rozwinięcia syndromu żalu patologicznego, co wymaga profesjonalnej i kompleksowej pomocy psychoterapeutycznej. W żalu patologicznym emocje po stracie dziecka są trwałe i nie mijają po upływie dłuższego czasu. Z upływem czasu problem narasta, obserwuje się niechęć do zaakceptowania poniesionej straty i niemożność podjęcia własnego życia [Craig, 2001, Mevorach-Zussman i wsp., 2012, Kagami i wsp., 2012].
Czynniki ryzyka dla rozwinięcia się patologicznego żalu po stracie dziecka to brak wsparcia ze strony rodziny oraz społeczeństwa, brak właściwej opieki socjalnej, istniejące uprzednio lub pojawiające się po stracie trudności w związku partnerskim, brak dzieci w związku, ambiwalentne uczucia co do decyzji ponownego zajścia w ciążę. Ważnym czynnikiem są również istniejące zaburzenia osobowości prowadzące niejednokrotnie do problemów psychiatrycznych. Ryzyko pojawienia się uczucia żalu patologicznego występuje również często po zakończeniu ciąży z powodu istniejących wad płodu. Ponadto badania wskazały, że kobiety i mężczyźni wykazują odmienne wzorce wyrażania żalu po stracie dziecka, a szczególnie żalu patologicznego, co dodatkowo może nasilać trudności komunikacyjne w związku partnerskim. Utrata płodu lub dziecka pozostawia bardzo duży wpływ psychiczny zarówno na osobowości indywidualne partnerów, jak i na funkcjonowanie całego związku. Niestety nie dysponujemy obecnie wystarczającą ilością badań dokumentujących ten problem. Brakuje szczególnie badań długoterminowych oceniających sekwencję następujących po sobie stanów emocjonalnych i ich wpływu na psychikę pacjentki [Kersting i wsp. 2012, Li i wsp., 2012].
W obecnym czasie dostępne szeroko media często sugerują społeczeństwu, że kariera zawodowa oraz rozwój indywidualny są ważniejsze od życia rodzinnego i planowanego rozrodu. Często te wyobrażenia w społeczeństwie doprowadzają do odkładania macierzyństwa na późniejszy wiek [Heazell i wsp., 2015]. Na podstawie długotrwałych obserwacji wiadomo, że zaawansowany wiek matki jest czynnikiem ryzyka niepłodności i wad genetycznych płodu [Coughlan i wsp., 2014, Heazell i wsp., 2015]. Z drugiej strony z powodu przesunięcia się wieku rozrodczego opieka położnicza obejmuje obecnie większą liczbę pacjentek w zaawansowanym wieku z poronieniami nawracającymi oraz
przebieg ciąży i porodu w zaawansowanym wieku matki. Należy dokładniej przedstawiać czynniki ryzyka i możliwe powikłania związane niejednokrotnie z ciążą po 40 roku życia. Ważne jest także przedstawienie obojgu partnerom dużego prawdopodobieństwa wystąpienia niepowodzeń położniczych w przypadku odkładania decyzji o zajściu w ciążę [Kolte i wsp., 2015, Sauer i wsp., 2015].
ETIOLOGIA PORONIEŃ NAWRACAJĄCYCH I ZGONÓW WEWNĄTRZMACICZNYCH
Przyczyny nawracających utrat ciąż są bardzo różnorodne i obejmują czynniki genetyczne, hormonalne, anatomiczne, immunologiczne, prozakrzepowe oraz środowiskowe. Stąd diagnostyka nawracających utrat ciąż jest trudna i niekiedy bardzo czasochłonna [Yu i wsp., 2002, Larsen i wsp., 2013]. Analiza przyczyn RPL powinna obejmować wszystkie możliwe czynniki z powyższych kategorii. Analizę tę należy rozpocząć od przeprowadzenia dokładnego wywiadu położniczego oraz szczegółowej oceny stanu zdrowia kobiety i jej partnera. Niekiedy potrzebna jest również specjalistyczna konsultacja internistyczna [Kaandorp i wsp., 2014]. Diagnostyka biochemiczna i hormonalna pomoże wykluczyć lub potwierdzić występowanie cukrzycy, czy chorób tarczycy. Dokładne badanie ultrasonograficzne może wskazać na wady macicy jako przyczynę nawracających utrat ciąż. Istotnym elementem są badania w kierunku trombofilii wrodzonej i nabytej. Absolutnie niezbędna jest diagnostyka obojga partnerów pod względem prawidłowości garnituru chromosomowego [Saravelos i wsp., 2012]. Innym, niemniej ważnym, punktem jest ocena występowania zakażeń układu rozrodczego. Pod uwagę należy wziąć także styl życia kobiety, wpływ stresu, stosowane używki, jak np. częste jeszcze w naszym społeczeństwie palenie papierosów [Saito, 2009, Clark i wsp., 2014].
Przyczyny poronień nawracających
Jako wiodącą przyczynę poronień samoistnych wskazuje się genetyczne nieprawidłowości występujące u płodu. Poronienia nawracające prawdopodobnie mają bardziej złożoną etiologię i spowodowane są obecnością nieprawidłowości chromosomalnych, ale również trombofilii u matki, dysfunkcji układu immunologicznego, zaburzeniami endokrynologicznymi. Jednak żadna z wymienionych powyżej przyczyn nie jest specyficzna tylko dla nawracających utrat ciąż. Dlatego w ostatnich latach powstały nowe koncepcje dotyczące etiologii poronień samoistnych i nawracających. Poronienia późne w II
trymestrze ciąży mają bardzo różnorodne przyczyny, najczęściej nakładające się na siebie nawzajem [McNamee i wsp., 2014, Afroze i wsp., 2014]. Dodatkowo pacjentki z poronieniami w II trymestrze ciąży w wywiadzie znajdują się w grupie zwiększonego ryzyka wystąpienia następnego poronienia oraz porodu przedwczesnego. Prawdopodobnie najbardziej różnorodną grupę pod względem przyczyn prezentują kobiety z niewyjaśnionymi poronieniami [Christiansen i wsp., 2006, McNamee i wsp., 2012, McNamee i wsp., 2014, Afroze i wsp., 2014].
Czynniki genetyczne
Od dawna wiadomo, że potencjał reprodukcyjny człowieka nie jest w pełni efektywny i nie wszystkie zaistniałe ciąże kończą się urodzeniem zdrowego donoszonego noworodka. Nieefektywność potencjału rozrodczego człowieka wynika z faktu, że już około 70% zapłodnionych zarodków ludzkich ulega poronieniu we wczesnym okresie ciąży [Hyde i wsp., 2015]. Najczęstszą przyczyną poronień samoistnych, jak również nawracających szczególnie w I trymestrze ciąży (najczęstsza przyczyna poronień przed 10 tc.) jest występująca u płodu aneuploidia. Z drugiej strony co najmniej 50% wszystkich poronień związanych jest z nieprawidłowościami cytogenetycznyczmi - trisomią, poliploidią i monosomią chromosomu X [Saito, 2009, Vaiman i wsp., 2015].
Uważa się, że w przypadku poronień nawracających istnieją dodatkowe, i nie zawsze wykryte, powtarzające się w kolejnych ciążach nieprawidłowości genetyczne. Stąd istnieje konieczność badania kariotypu obojga rodziców dla stwierdzenia etiologii poronień i rokowania przebiegu następnej ciąży. W 2-4% przypadków par z RM jeden z partnerów (najczęściej kobieta) wykazuje rearanżacje strukturalne chromosomów. Najczęściej są to translokacje zrównoważone. Z wysokim ryzykiem poronień związane są także inwersje chromosomów. Z drugiej strony badania pokazują, że sperma mężczyzn z par, u których odnotowano poronienia nawracające wykazuje wysoki stopień uszkodzenia DNA i nieprawidłowej budowy chromosomów [Christiansen i wsp., 2006, Hyde i wsp., 2015].
Stąd ważna rola przeprowadzanych obecnie testów genetycznych, jak badania kariotypu obydwojga rodziców, określenia nieprawidłowości struktury i liczby chromosomów (badania microarray) [Kutteh, 2015]. W poronieniach nawracających ważnym punktem jest badanie genetyczne fragmentów kosmówki uzyskanych po wyłyżeczkowaniu jamy macicy. Ma to znaczenie wyjaśniające bezpośrednio przyczynę poronienia, jak również znaczenie
poronieniami nawracającymi obiecujące rezultaty daje również genetyczna diagnostyka przedimplantacyjna [Hyde i wsp., 2015].
Czynniki hormonalne i endokrynne
Zaburzenia hormonalne są przyczyną około 8-15% poronień nawracających. Zarówno lokalny maciczno-łożyskowy, jak i matczyny system hormonalny jest niesłychanie ważny w utrzymaniu i prawidłowym rozwoju wczesnej ciąży [Larsen i wsp., 2013]. W tym zakresie najczęstszymi przyczynami RM u matki są niewydolność fazy lutealnej, zaburzenia czynności tarczycy, zespół policystycznych jajników (PCOS – polycystic ovary syndrome), hiperprolaktynemia i zaburzenia hormonalne oraz insulinooporność w przebiegu cukrzycy [Carp, 2015]. Również podwyższony poziom androgenów u kobiet oraz endometrioza uważane są przez niektórych autorów za przyczyny RM [Pluchino i wsp., 2014].
U około 8-10% kobiet z poronieniami nawracającymi stwierdza się zespół PCO co związane jest hiperandrogenemią, otyłością i hiperinsulinemią. Mechanizm poronień w PCOS skorelowany jest z otyłością i insulinoopornością. W dalszym następstwie powoduje to zaburzenia odpowiedzi fibrynolitycznej i prowadzi do nieprawidłowej implantacji embrionu [Arredondo i wsp., 2006]. Dyskusyjna jest natomiast rola udziału zwiększonego poziomu prolaktyny oraz niewydolności fazy lutealnej w patomechanizmie RM. Z drugiej strony wykazano korzystną rolę podawania bromokryptyny i kabergoliny w redukcji wskaźnika poronień u niektórych kobiet z RM [Arredondo i wsp., 2006].
Zarówno hipo-, jak i hipertyreoza może być przyczyną nieprawidłowego przebiegu ciąży i złego stanu urodzeniowego noworodka. Subkliniczna postać hipotyreozy i obecność przeciwciał przeciwtarczycowych powodują wzrost ryzyka wystąpienia RPL. Niektóre badania przeprowadzone u kobiet z subkliniczną postacią hipotyreozy pokazują obniżenie ryzyka RM, porodu przedwczesnego jak również poprawę stanu noworodka w przypadku zastosowanego leczenia. Inne analizy wskazują na brak jakichkolwiek korzyści w powyższym przypadku. Obecność przeciwciał przeciwtarczycowych wiązana jest z poronieniami samoistnymi, nawracającymi, jak również z porodem przedwczesnym. Obecne rekomendacje wskazują na potrzebę leczenia zarówno hipo-, jak i hipertyreozy. Również subkliniczna hipotyreoza w przebiegu ciąży wymaga leczenia substytucyjnego [Sarkar i wsp., 2012, Negro i wsp., 2014].
Niewątpliwie również choroby autoimmunologiczne związane są z występowaniem RM (także te przebiegające z eutyreozą). Interesującym faktem jest również odnotowanie
wzrostu ryzyka niepłodności oraz poronień nawracających u kobiet z niskim poziomem przeciwciał przeciwtarczycowych oraz obniżonym poziomem witaminy D [Twig i wsp., 2012]. Co więcej opisano interakcję pomiędzy przeciwciałami przeciwtarczycowymi oraz antyfosfolipidowymi i ich znaczenie w etiologii RM [De Carolis i wsp., 2004].
Czynniki anatomiczne
Potwierdzone wady anatomiczne macicy stanowią przyczynę poronień nawracających u około 10-15% kobiet. Najczęstsza wada macicy to przegroda macicy, co powoduje niekiedy znacznego stopnia niedokrwienie macicy w obrębie przegrody i nieprawidłowy rozwój zarodka i na tym tle wystąpienie poronień nawracających. Przyjmuje się, że im większa przegroda tym większe prawdopodobieństwo wystąpienia poronienia. Dodatkowo zaobserwowano, że u kobiet z macicą łukowatą częściej dochodzi do poronień późnych w II trymestrze ciąży [Guimarães Filho i wsp., 2006a, Ford i wsp., 2009].
Również mięśniaki podśluzówkowe oraz włókniaki mogą być przyczyną deformacji jamy macicy oraz błony śluzowej macicy. W ten sposób niekorzystnie wpływają na implantację, oraz w następstwie, powodują wzrost ryzyka wystąpienia RM. Natomiast związek pomiędzy mięśniakami śródściennymi i podsurowicówkowymi a ryzykiem RM jest nadal kontrowersyjny [Guimarães Filho i wsp., 2006b].
Adenomioza nie jest bezpośrednio związana z niepłodnością jednak wcześniejsze studia pokazały, że adenomioza w mechanizmie immunologicznym może powodować wystąpienie RM. Nadal dyskusyjny jest związek zespołu Ashermana, zrostów wewnątrzmacicznych, polipów endometroidalnych oraz endometriozy z bezpośrednim występowaniem RM [Tomassetti i wsp., 2006]. Natomiast niewydolność cieśniowo-szyjkowa może być przyczyną późnych poronień nawracających w II trymestrze ciąży [Saito, 2009].
Czynniki immunologiczne Zespół antyfosfolipidowy
Dużo badań wskazuje na związek pomiędzy obecnością przeciwciał antyfosfolipidowych (APL – antiphospholipid antibodies) a występowaniem RM, szczególnie we wczesnym I trymestrze ciąży [Wong i wsp., 2014, Esteve-Valverde i wsp., 2015]. Obecność przeciwciał antyfosfolipidowych wiąże się ze zmianami prozakrzepowymi w drobnych naczyniach żylnych
Wong i wsp. 2014]. Obecność przeciwciał APL jak przeciwciała antykardiolipinowe (aCL - anticardiolipin antibodies), przeciwciała przeciw beta2-glikoproteinie I (GPI - β2-glycoprotein I antibodies) oraz antykoagulant tocznia (LA – lupus anticoagulant) u ciężarnych związana jest z występowaniem wielu powikłań. Najczęściej wymieniane tu są: poronienia nawracające, stan przedrzucawkowy (szczególnie postać wczesna early-onset PE), zespół HELLP (Hemolytic anemia, Elevated Liver enzymes, Low Platelet count), poród przedwczesny, wewnątrzmaciczne ograniczenie wzrastania płodu (IUGR – intruterine growth restriction), zgon wewnątrzmaciczny, przedwczesne oddzielenie łożyska, obecność krwiaka podkosmówkowego [de Jesus i wsp., 2014, Patil i wsp., 2015].
Rozpoznanie zespołu antyfosfolipidowego (APS – antiphospholipid syndrome) powinno nastąpić na podstawie kryteriów opracowanych i przyjętych na międzynarodowym kongresie w Sydney (2006) i obejmować kryteria kliniczne i laboratoryjne [Miyakis i wsp., 2006]. U 5-15% kobiet z RM spostrzega się podwyższone miano przeciwciał APL. Rozpoznanie klasycznego położniczego APS odnosi się do kobiet, u których miano przeciwciał wzrasta tylko w ciąży i w czasie diagnostyki nie występuje żylna choroba zakrzepowo-zatorowa. Istnieją dowody wskazujące na korzyści zastosowania profilaktyki przeciwzakrzepowej u kobiet z zespołem APS pozwalającej na uniknięcie powikłań związanych z obecnością przeciwciał APL [Ernest i wsp., 2011, de Jesus i wsp., 2014].
Dysfunkcja autoimmunologiczna
Podczas ciąży matczyny układ immunologiczny musi ulec specjalnym zmianom pozwalającym na tolerancję semi-allogenicznego przeszczepu jakim jest płód. W zmianie odpowiedzi immunologicznej u matki niesłychanie istotną rolę odgrywają jednostka płodowo-maciczna oraz mechanizmy lokalne i systemowe [Quenby i wsp., 2006]. Podkreśla się uprzywilejowana rolę stanu immunologicznego płodu, a wiele autorów próbuje również wyjaśnić zaangażowanie procesów immunologicznych w patofizjologię RM w badaniach przeprowadzanych na zwierzętach doświadczalnych [Bonney i wsp., 2014]. Dokładny jednak przebieg procesu, który zapobiega odrzuceniu płodu nie jest do końca poznany.
Obecnie sugeruje się, że w etiologii RM udział biorą dysregulacja immunologiczna oraz zaburzenia w budowie DNA w plemnikach [Larsen i wsp., 2013]. Dla prawidłowego przebiegu procesu implantacji potrzebne jest więc działanie wielu mediatorów immunologicznych, które regulują kolejne etapy inwazji trofoblastu. Prawdopodobnie kluczowym mechanizmem dla właściwego rozwoju ciąży jest utrzymanie równowagi w układzie cytokin Th1/Th2 z przewagą korzysteno działania cytokin typu Th2 [Krieg i wsp.,
2015]. Innym mechanizmem korzystnym dla prawidłowego rozwoju wczesnej ciąży jest redukcja aktywności komórek natural killers w macicy [Ford i wsp., 2009]. Prawdopodobnie również złożona równowaga pomiędzy progesteronem, gonadotropiną kosmówkową (beta-hCG) i łożyskowym czynnikiem wzrostu (PGF - placental growth factor), wpływa na odpowiedź immunologiczną i mechanizmy matczynej tolerancji na płodowe i ojcowskie antygeny [Ford i wsp., 2009]. W badaniach doświadczalnych na zwierzętach zaburzenia w zakresie powyższych procesów immunologicznych są przyczyną poronień nawracających [Ford i wsp., 2009, Krieg i wsp., 2015].
Przyczyną poronień nawracających mogą być również inne procesy zapalne, jak zapalenie błony śluzowej macicy (endometritis), czy procesy zapalne przebiegające w jajowodach [Saito, 2009, Ford i wsp., 2009].
Badania przyczyn RM skupiają się również na zaburzeniach na zaburzeniach spermatogenezy, jak również na procesach regulacji implantacji wynikających z zaburzenia odpowiedzi endometrium na implantację [Saravelos i wsp., 2012].
Czynniki infekcyjne
Infekcje są stosunkowo rzadką przyczyną poronień samoistnych i nawracających. Ocenia się, że 1 do 4% RM spowodowane jest infekcjami bakteryjnymi oraz wirusowymi. Obecność czynników infekcyjnych związana jest przede wszystkim z poronieniami wczesnym [Nigro i wsp., 2011]. Za najczęstsze czynniki etologiczne uważa się mikroorganizmy z rodzaju Chlamydia, Mycoplasma, Ureaplasma, Listeria, Toxoplasmosa, Rubella, Cytomegalovirus, Herpes virus, Parvovirus [Saito, 2009, Ford i wsp., 2009]. Mechanizmy włączone w patofizjologię RM w przypadku infekcji to powstawanie toksycznych metabolitów, rozwój odpowiedzi immunologicznej w procesie zapalnym, przewlekłe zapalenie błony śluzowej macicy oraz wystąpienie zapalenia błon płodowych i kosmówki (chorioamnionitis). Wiele badań wykazuje związek poronień nawracających z obecnością Chlamydia trachomatis w pochwie i kanale szyjki macicy [Eggert-Kruse i wsp., 2014, Kishore i wsp., 2003]. Ciekawe doniesienia związane są z obecnością zakażenia wirusami HPV i występowaniem poronień [Ticconi i wsp., 2013]. Również wirusy z rodzaju Herpes będąc przyczyną nawracających infekcji dróg rodnych mogą powodować nawracające utraty ciąży. W grupie kobiet z waginozą bakteryjną częściej obserwowano występowanie poronień nawracających. W doniesieniach wskazuje się na możliwą rolę infekcji
Z pewnością u kobiet z wywiadem obciążonym poronieniami nawracającymi istnieje potrzeba przeprowadzenia diagnostyki również kierunku obecności infekcji bakteryjnych i wirusowych celem włączenia antybiotykoterapii celowanej lub leczenia lekami przeciwwirusowymi [Rekomendacje Practice Committee of the American Society for Reproductive Medicine 2012].
Czynniki środowiskowe
Na podstawie badań wskazuje się na wpływ niektórych niekorzystnych czynników środowiskowych na występowanie nawracających utrat ciąż. Co więcej sugeruje się współdziałanie czynników środowiskowych i czynników genetycznych w etiologii RM oraz IUFD. Palenie papierosów, nadmierne spożycie kofeiny oraz alkoholu, jak również stosowanie narkotyków (kokaina) uznawane są jako możliwe przyczyny RPL. Spostrzega się także większy odsetek niepowodzeń położniczych u kobiet otyłych.
Obecnie uważa się, że już małe ilości alkoholu podwyższają ryzyko wystąpienia poronienia, a ryzyko wzrasta proporcjonalnie do ilości spożywanego alkoholu na dobę. Spożywanie ponad 4 drinków na tydzień powoduje znaczny wzrost ryzyka wystąpienia poronienia w I trymestrze ciąży (WR=2,82) [Andersen i wsp., 2012]. Wiele badań dotyczy również spożywania kofeiny przez kobiety ciężarne. Tutaj nie spostrzega się wzrostu ryzyka wystąpienia poronienia przy spożywaniu 1-2 filiżanek kawy dziennie. Tylko w przypadku gdy ciężarna spożywa ponad 7 filiżanek kawy na dzień spostrzeżono większe ryzyko wystąpienia poronienia (WR=1,48) [Bech i wsp., 2005].
Palenie papierosów jest dobrze udokumentowanym czynnikiem ryzyka wystąpienia powikłań naczyniowych w krążeniu łożyskowo-macicznym w późnej ciąży. Sprzeczne doniesienia dotyczą natomiast wystąpienia poronień, w tym również poronień nawracających. Niektóre badania donoszą o znacznym wzroście ryzyka poronień u kobiet palaczek papierosów [Saravelos i wsp., 2011]. Natomiast duże prospektywne badanie (24608 ciężarnych) nie pokazało wzrostu ryzyka wystąpienia poronienia u kobiet palaczek [Wisborg i wsp., 2003].
Innym czynnikiem zwiększającym ryzyko poronienia jest otyłość u matki. Metwally i wsp. w przeprowadzonej meta-analizie pokazali wzrost ryzyka poronień samoistnych i nawracających u kobiet ze wskaźnikiem masy ciała (BMI – body mass index) powyżej 25 kg/m2 w porównaniu do kobiet z BMI poniżej 25 kg/m2 [Metwally i wsp., 2008].
Niektóre przeprowadzone badania analizują również związek występowania poronień samoistnych i nawracających z niekorzystnym oddziaływaniem stresu i ćwiczeń fizycznych u ciężarnych. Zależność ta pozostaje jednak dyskusyjna [Saravelos i wsp., 2011].
Trombofilia wrodzona
Niewatpliwie istotną rolę w etiologii nawracających utrat ciąż odgrywają warianty polimorficzne genów włączonych w patomechanizm poronień nawracających i zgonu wewnątrzmacicznego w II połowie ciąży. Szczególną uwagę zwraca się na polimorfizmy w zakresie układu krzepnięcia i fibrynolizy, których obecność wiąże się z gotowością prozakrzepową i zmianami w krążeniu maciczno-łożyskowym [Saito, 2009, Ford i wswp., 2009, Rambaldi i wsp., 2014]. Obecnie istnieje wiele badań dokumentujących związek trombofilii wrodzonej z występowaniem nawracających niepowodzeń położniczych. Mechanizmem łączącym trombofilię wrodzoną z występowaniem poronień i obumarcia wewnątrzmacicznego jest zakrzepica w drobnych naczyniach krążenia maciczno-łożyskowego [Bonnar i wsp. 1998, Bonnar i wsp., 1999, Middeldorp i wsp., 2014].
Za najistotniejsze przyczyny trombofilii wrodzonej uważa się obecność czynnika V Leiden (1691G>A) (FVL – factor V Leiden), polimorfizmu 20210G>A genu protrombiny (PTM – prothrombin mutation), polimorfizmów czynnika VII krzepnięcia, genu inhibitora aktywatora plazminogenu typu 1 (PAI-1 – inhibitor acivator plazminogen 1), czy polimorfizmu genu reduktazy metylenotetrahydrofolianowej (MTHFR – methyltetrahydrofolate reductase). Za rzadsze przyczyny nawykowych niepowodzeń uważa się niedobór białka C, białka S oraz antytrombiny III. Badanie potwierdzające znaczenie trombofilii wrodzonej w etiologii nawracających utrat ciąż prowadzone są w wielu ośrodkach na całym świecie i dotyczą różnych etnicznie populacji [Kupferminc i wsp., 1999, Alonso i wsp., 2002, Kist i wsp., 2008, Bennet i wsp., 2012, Vaiman i wsp., 2015].
Niektórzy autorzy wskazują również na wzrost ryzyka wystąpienia niepowodzeń w ciąży, w tym szczególnie RM oraz IUFD u kobiet nosicielek trombofilii złożonej [Larciprete i wsp., 2010]. Warto zwrócić uwagę, że dotąd opublikowano mało badań dotyczących związku trombofilii ojcowskiej z występowaniem poronień nawracających i zgonu
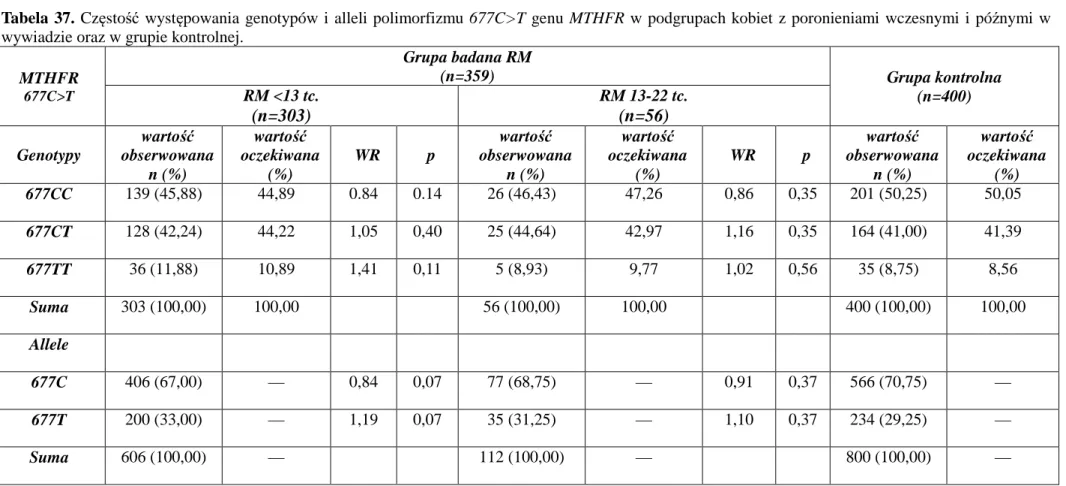
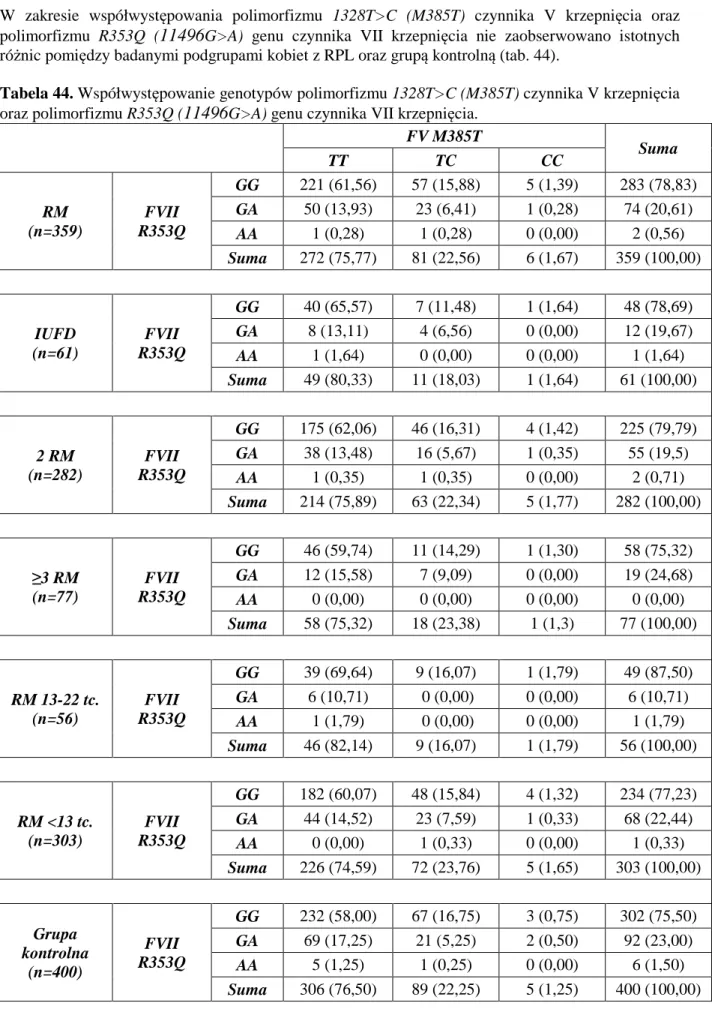
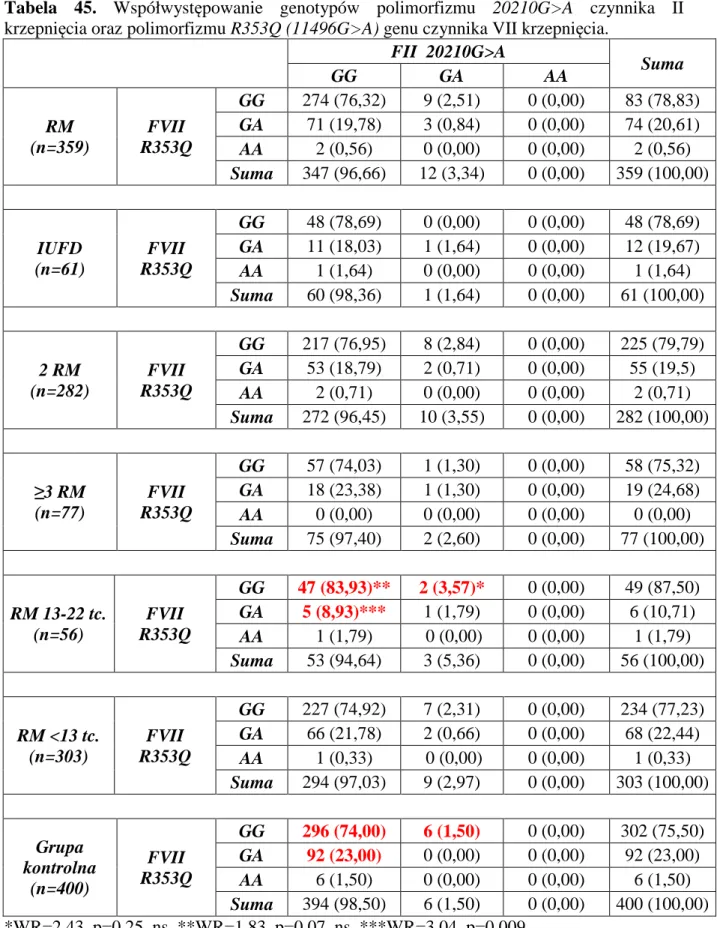
Najczęstsze przyczyny, najczęściej stosowane metody diagnostyczne oraz możliwości terapeutyczne w przypadku poronień nawracających przedstawiono w tabeli 1.
Tabela 1. Przyczyny, diagnostyka oraz możliwości terapeutyczne poronień nawracających.
Przyczyny Diagnostyka Możliwości terapeutyczne
Czynniki genetyczne Aberracje chromosomalne - trisomia, monosomia X, triploidia, tetraploidia
Aberracje strukturalne - translokacje niezrównoważone
Mutacje jedno- i wielogenowy (np. mutacje w genie dla kolagenu)
Oznaczanie kariotypu rodziców Poradnictwo genetyczne IVF po wykonaniu
przedimplantacyjnej diagnostyki genetycznej
Czynniki hormonalne Niewydolność fazy lutealnej Hiperprolaktynemia
Hipotyreoza
Zaburzenia wydzielania gonadotropin Niewyrównana cukrzyca
Badania hormonalne (TSH, T3, T4, PRL) Test insulinooporności
Test rezerwy jajników
Przeciwciała przeciwtarczycowe
Terapia hormonalna (suplementacja II fazy cyklu, podawanie hormonów tarczycy, metformina)
leczenie cukrzycy
Czynniki anatomiczne Wady wrodzone - przegroda macicy, macica podwójna, dwurożna, łukowata
Zespół Ashermana
Niewydolność cieśniowo-szyjkowa
Ultrasonografia 2D lub 3D Histerosalpingografia Histeroskopia
Histeroscopia - Resekcja przegrody, zrostów, mięśniaków podśluzówkowych
Myomektomia – w przypadku mięśniaków śródściennych i podsurowicówkowych >5 cm
Czynniki infekcyjne TORCH
Chlamydia, Ureaplasma, Mycoplasma Listeria monocytogenes
Posiew z kanału szyjki i pochwy Panel urogenitalny
Terapia antybiotykowa
Czynniki środowiskowe
Palenie papierosów, alkohol, narkotyki Palenie papierosów Alkohol
Narkotyki
Poradnictwo psychologiczne
Odsunięcie od czynników narażenia
Czynniki
immunologiczne
Trombofilia nabyta – zespół APS Poziom przeciwciał APL (kardiolipina, antykoagulant tocznia, przeciwciała przeciwko B2-glikoproteinie I)
Profilaktyka ASA oraz LMWH w małych dawkach
Trombofilie wrodzone Obecność polimorfizmów w czynnikach układu krzepnięcia i fibrynolizy
Poziom homocysteiny
Oporność na aktywowane białko C
Oznaczanie mutacji Leiden, protrombiny MTHFR
Profilaktyka ASA oraz LMWH w małych dawkach
Hiperhomocysteinemia – podawanie FA, wit. B6, B12
Etiologia zgonów wewnątrzmacicznych
Przyczyny zgonów wewnątrzmacicznych najczęściej można zakwalifikować jako matczyne, płodowe lub łożyskowe. Do czynników matczynych należą czas trwania ciąży >42 tc., nieprawidłowo kontrolowana cukrzyca, choroby towarzyszące: toczeń układowy, zespół antyfosfolipidiwy, infekcje, nadciśnienie tętnicze, stan przedrzucawkowy/rzucawka, hemoglobinopatie. Jako przyczyny matczyne wymienia się także zaawansowany wiek matki, konflikt serologiczny, pęknięcie macicy, uraz lub nagły zgon matki. W tej grupie przyczyn znajdują się również trombofilie wrodzone i nabyte. Czynniki płodowe wpływające na wystąpienie IUFD to ciąża wielopłodowa, wewnątrzmaciczne ograniczenie wzrastania płodu, wady wrodzone, nieprawidłowości genetyczne, infekcje, obrzęk uogólniony o różnej etiologii. Ostatnie grupa przyczyn łożyskowych przyczyn IUFD obejmuje nieprawidłowości dotyczące pępowiny, przedwczesne oddzielenie łożyska, przedwczesne pęknięcie błon płodowych, naczynia przodujące, krwotok płodowo-matczyny, niewydolność łożyskowa) [Rekomendacje Stillbirth Collaborative Research Network Writing Group 2011]. Niestety etiologia zgonów wewnątrzmacicznych w II połowie ciąży pozostaje nieznana w aż w 25-60% przypadków.
Wyniki jednej z analiz wskazują, że czynnik łożyskowy występuje aż w 64,9% przypadków późnych zgonów wewnątrzmacicznych [Korteweg i wsp., 2009]. Metaanaliza 96 badań populacyjnych wykazała, że matczyna nadwaga oraz otyłość jest najważniejszym modyfikowalnym czynnikiem ryzyka. Istotnym natomiast czynnikiem ryzyka wystąpienia IUFD jest zaawansowany wiek matki (>35 rż.) oraz palenie tytoniu. Czynnikami największego ryzyka okazały się natomiast wewnątrzmaciczne ograniczenie wzrastania płodu oraz oddzielenie łożyska [Flenady i wsp., 2011, Aune i wsp., 2014]. Co więcej, cukrzyca przedciążowa oraz nadciśnienie przewlekłe i w rozwijające się w przebiegu ciąży również znacznie zwiększają ryzyko występowania tego powikłania położniczego [Gardosi i wsp., 2013]. Późne utraty ciąż częściej występują u Afroamerykanek, u pacjentek z obciążonym wywiadem w kierunku obumarcia wewnątrzmacicznego w II trymestrze ciąży lub IUGR, u pacjentek z niemożnością donoszenia ciąży, a także w przypadku zaawansowanego wieku ojca [Gardosi i wsp., 2013].
Ustalenie przyczyny zgonu wewnątrzmacicznego w II połowie ciąży jest niezwykle istotne z uwagi na przyszłe poradnictwo przedkoncepcyjne, prowadzenie kolejnej ciąży, czy diagnostykę prenatalną. W przypadku oczywistych przyczyn, jak np. wypadnięcie pępowiny dalsze badania zwykle nie są konieczne. W sytuacji anencefalii płodu, przedwczesnego
oddzielania łożyska dalsze analizy ogranicza się do badań toksykologicznych oraz badań przesiewowych w kierunku trombofilii. Jednak biorąc pod uwagę fakt, że aż w 60% przypadków etiologia pozostaje niejasna najważniejszym badaniem jest sekcja płodu. Alternatywą jest przeprowadzenie rezonansu magnetycznego obumarłego płodu. Co więcej, należy wnikliwie zbadać histopatologicznie łożysko oraz błony płodowe, łącznie z wykonaniem posiewów bakteriologicznych. Niezwykle istotne są również badania genetyczne płodu, ewentualnie obojga rodziców.
Wyróżnia się wiele systemów klasyfikacji przyczyn w etiologii zgonów wewnątrzmacicznych. Najbardziej znanymi jest klasyfikacja Tulip, w modyfikacji Wigglesworth oraz Aberdeen. Obecnie korzysta się również z klasyfikacji Re Co De (Relevant Condition at Death) oraz klasyfikacji utworzonej przez Australijskie Towarzystwo Medycyny Perinatalnej opisywanej skrótem PSANZ-PDC (Perinatal Society of Australia and New Zealand - Perinatal Death Classification). Klasyfikacje Wigglesworth, oraz Aberdeen wskazują tylko matczyne i płodowe czynniki jako przyczyny zgonu wewnątrzmacicznego, natomiast klasyfikacje Tulip oraz PSANZ-PDC oprócz matczynych i płodowych, analizują również łożyskowe czynniki mające wpływ na zgon wewnątrzmaciczny [Choudhary i wsp., 2014, Korteweg i wsp., 2008, Lu i wsp., 2009]. Określenie przyczyny IUFD jest niesłychanie istotne dla prowadzenia następnych ciąż, niestety w większości przypadków IUFD przyczyna pozostaje nieznana [Korteweg i wsp., 2006, Gordijn i wsp., 2009].
Wiele badań dotyczy przyczyn etiologicznych IUFD. Ogólnie przyjmuje się, że ciąża po uprzednim IUFD wykazuje 2-10-krotny wzrost ryzyka wystąpienia następnego epizodu IUFD, jak również wzrost wystąpienia innych powikłań. Lęk związany z obawą przed następnym niepowodzeniem, jak również wystąpienie innych komplikacji w ciąży wiąże się n niejednokrotnie z pojęciem decyzji o wcześniejszym zakończeniu porodu. Jednak niektóre badania pokazują, że poród przed 39 tc. nie prowadzi do redukcji ryzyka IUFD i redukcji wystąpienia innych powikłań u kobiet z wcześniejszym IUFD. Wybór optymalnego czasu zakończenia ciąży u kobiet z wcześniejszym epizodem IUFD jest bardzo trudny i wymaga dużego doświadczenia klinicznego [Silver i wsp., 2011]. W badaniu Heuser i wsp. oceniano ryzyko pojawienia się następnego IUFD w zależności od wieku ciążowego wystąpienia poprzedniego epizodu IUFD. Retrospektywnie oceniano grupę kobiet, które urodziły martwy płód z co najmniej jeszcze jedną ciążą po epizodzie IUFD. Analizowano grupę 2 887 matek oraz 5 090 następnych porodów w tej grupie. U kobiet, u których IUFD wystąpiło pomiędzy
zwiększone ryzyko wystąpienia następnego epizodu IUFD. Wiek ciążowy pierwszego epizodu IUFD stanowi czynnik predykcyjny wystąpienia następnego epizodu IUFD. Ten efekt jest bardzo wyraźny u kobiet z bardzo wczesnymi obumarciami oraz z epizodem IUFD po terminie porodu [Heuser i wsp., 2014].
Wydaje się rónież, że określenie przyczyny IUFD i udziału czynników ryzyka powinno następować z zastosowaniem takiej samej klasyfikacji we wszystkich przypadkach IUFD u tej samej kobiety. Powoduje to lepsze zrozumienie patofizjologii IUFD i powoduje wzrost przewidywalności wystąpienia następnego epizodu IUFD [Nijkamp i wsp., 2013]. Ciekawe badanie dotyczyło oceny wpływu obecności przeciwciał APL na wystąpienie IUFD. Retrospektywnie 515 pacjentek badano na obecność przeciwciał (przeciwjądrowych, przeciwmitochondrialnych, przeciwciał przeciw peroksydazie, przeciw tyroglobulinie oraz przeciwciała APL). Z wszystkich pacjentek 212 miało jeden lub więcej rodzajów przeciwciał, natomiast u 303 pacjentki nie potwierdzono obecności żadnego rodzaju przeciwciał. Z całej grupy u 119 pacjentek stwierdzono obecność RPL (2 lub więcej utrat ciąż) [Mumusoglu i wsp., 2015]. Częstość IUFD była statystycznie istotnie wyższa u kobiet z pozytywnym wynikiem w kierunku obecności jednego lub więcej rodzaju przeciwciał (17,0% vs. 10,6%, p = 0,002). Stąd u kobiet z wywiadem w kierunku IUFD powinien zostać rozważony skrinning w kierunku obecności niektórych przeciwciał [Mumusoglu i wsp., 2015].
Interesujące przeprowadzili również Pariente i wsp. oceniając u kobiet z IUFD zwiększenie ryzyka wystąpienia arterosklerozy i powikłań naczyniowych w późniejszym okresie życia [Pariente i wsp., 2014]. Analizę długoterminowych powikłań związanych z arterosklerozą naczyń przeprowadzono w grupach kobiet z lub bez wcześniejszego epizodu IUFD (analiza na przestrzeni 25 lat). Z ogólnej liczby 99 280 porodów włączonych do badania 1 879 porodów (1,9%) nastąpiło u pacjentek z co najmniej 1 wcześniejszym epizodem IUFD. Pacjentki z przebytym epizodem IUFD wykazywały znacząco wyższe ryzyko wystąpienia chorób sercowo-naczyniowych i chorób nerek. Znaleziono również związek pomiędzy liczbą IUFD a zwiększonym ryzykiem chorób sercowo-naczyniowych w póżniejszym życiu. IUFD jest niezależnym czynnikiem ryzyka dla długoterminowych zmian aterosklerotycznych w naczyniach matki, a ryzyko to rośnie wraz ze wzrostem liczby epizodów IUFD [Pariente i wsp., 2014].
Szczególną pozycję w etiologii IUFD zajmuje czynnik matczyny, jakim jest trombofilia wrodzona spowodowana obecnością polimorfizmów genów kaskady krzepnięcia i fibrynolizy [Hefler i wsp., 2004, Simchen i wsp., 2010, Flenady i wsp., 2011].
POLIMORFIZMY UKŁADU KRZEPNIĘCIA I FIBRYNOLIZY
Układ krzepnięcia i fibrynolizy jest szeregiem procesów zapewniających właściwą hemostazę w organizmie człowieka. Aktywacja procesów przebiega w sposób kaskadowy i bardzo dynamiczny, a aktywne postaci czynników krzepnięcia powstają ze swoich nieaktywnych prekursorów. Ważną rolę w kaskadzie krzepnięcia odgrywa wspólne działanie niektórych czynników. Jednym z kompleksów czynników jest kompleks tenazy (czynnik VIIIa-IXa-X, fosfolipidy, jony wapnia), w którym aktywacji ulega czynnik X, drugim natomiast kompleks protrombinazy (Va-Xa-II, fosfolipidy, jony wapnia), w którym aktywacji ulega czynnik II (przekształcenie protrombiny w trombinę) [Hoffman i wsp., 2001, Lewandowski, 2010].
Obecnie wyróżnia się stan spoczynkowy i stan aktywny ukłau krzepniecia. Aktywny stan ma miejsce w przypadku uszkodzenia ściany naczynia i rozpoczęcia procesu generacji trombiny na fibroblastach i kolagenie ściany naczynia. Następuje szybkie gromadzenie się płytek krwi, które pokrywają miejsce uszkodzenia. Dalszy proces toczy się już na fosfolipidach płytek krwi, gdzie uaktywniane są kompleksy tenazy i protrombinazy. W stanie aktywnym, na skutek uszkodzenia ściany naczynia, dochodzi do szybkiej generacji trombiny w fazie inicjacji oraz fazie rozprzestrzeniania [Hoffman i wsp., 2001].
W fazie spoczynkowej obserwuje się tzw. krzepnięcia podprogowe. W trombofilii wrodzonej w obecności np. czynnika V Leiden (1691G>A) oraz mutacji protrombiny (20210G>A) szczególnie nasilony jest proces krzpnięcia podprogowego, które u kobiet ciężarnych może powodować zwiększone wykrzepianie w naczyniach krążenia maciczo-łożyskowego. W łożysku obserwowane są zakrzepy i zawały oraz zmiany zakrzepowo-zapalne [Rao i wsp., 1998]. Zakrzepy najczęściej zlokalizowane są międzykosmkowo. W przypadku naczyń wyróżnia się mikrozakrzepy w naczyniach kosmkowych oraz zakrzepy w innych większych naczyniach krążenia maciczno-łożyskowego. W tętnicach spiralnych natomiast obserwuje się proces miażdzycopodobny i zaburzoną inwazję trofoblastu do ścian naczyń. W następstwie tych procesów dochodzi do rozwoju wielu powikłań położniczych [Kupferminc i wsp., 1999].
TROMBOFILA WRODZONA JAKO PRZYCZYNA NAWRACAJĄCYCH UTRAT CIĄŻ
CZYNNIK V KRZEPNIĘCIA – POLIMORFIZM 1691G>A ORAZ 1328C>T
Czynnik V krzepnięcia, nazywany również proakceleryną, chemicznie jest glikoproteiną o ciężarze około 300 kilo Daltonów [Segers i wsp., 2007]. W procesie krzepnięcia połączenie aktywnych postaci czynnika V oraz X powoduje znaczne przyspieszenie reakcji przekształcania protrombiny w α-trombinę w porównaniu do działania samego aktywnego czynnika X [Barhoover i wsp., 2011, Hirbawi i wsp., 2010, Kalafatis i wsp., 2001].
W przebiegu prawidłowej kaskady krzepnięcia aktywna postać czynnika V oraz VIII jest unieczynniana dzięki działaniu aktywowanego kompleksu białka C (APC – activated protein C). Białko to jest jednym z kluczowych, endogennych inhibitorów kaskady krzepnięcia (obok antytrombiny III, białka S oraz białka Z) biorących udział w regulacji hemostazy [Dahlbäck, 2008a]. Reakcja ta przebiega w obecności nieenzymatycznego kofaktora - białka S oraz jonów Ca+2. Aktywna postać FVa jest neutralizowana poprzez proteolityczne cięcie łańcucha ciężkiego w kilku miejscach. Pierwszą reakcją jest cięcie w pozycji Arg506, co pociąga za sobą szybsze czasowo cięcie w miejscu Arg306, a następnie cięcie w pozycji Arg679 oraz Lys994 [Dahlbäck, 2008b, Barhoover i wsp., 2011, Hirbawi i wsp., 2010].
W roku 1993 Dahlback i wsp., w toku badań nad rodzinnym występowaniem żylnej choroby zakrzepowo-zatorowej zademonstrowali niedobór kofaktora dla działania APC, co opisali jako zjawisko oporności na działanie aktywowanego białka C (APCR - activated protein C resistance) [Dahlback i wsp., 1994]. Zjawisko to spowodowane jest obecnością mutacji punktowej w genie kodującym V czynnik krzepnięcia. W dalszej konsekwencji, w 1994 roku Bertina i wsp. zidentyfikowali istnienie mutacji punktowej (1691G>A) w eksonie 10 genu kodującego V czynnik krzepnięcia. Mutacja ta, od nazwy miejscowości, nazwana została mutacją Leiden (FVL) [Bertina i wsp., 1994]. Tranzycja dotycząca zasad purynowych: zamiany guaniny na adeninę (CGA 1691 CAA) powoduje jednocześnie zmianę sekwencji w łańcuchu białkowym czynnika V, gdzie w pozycji 506 łańcucha aminokwas arginina jest zastępowany przez glutaminę i miejsce cięcia Arg505/Arg506 ulega zamianie na Arg505/Gln506 (Arg506Gln, R506Q). Wystąpienie oporności na działanie białka C związane jest z obecnością genotypu hetero- lub homozygotycznego zmutowanego (1691GA, 1691AA)
Ponieważ pozycja Arg506 jest jedną z pozycji proteolitycznego cięcia w procesie inaktywacji FVa przez kompleks APC-PS, w przypadku obecności mutacji Gln506 inaktywacja czynnika V zachodzi około 10 razy wolniej, głównie poprzez wolniejsze czasowo cięcie w pozycji Arg306 przez co działanie FVa jest przedłużone i powoduje nasilenie procesu wykrzepiania. Dodatkowo obecność zmiany typu Gln506 uniemożliwia również efektywne działanie FVa jako kofaktora w inaktywacji FVIIIa [Lane i wsp., 2000, Barhoover i wsp., 2011, Hirbawi i wsp., 2010]. Zmutowany FVL wykazuje taką sama aktywność prokoagulacyjną, natomiast jest niepodatny na hydrolizę przez białko APC. W wyniku tego następuje stabilizacja kompleksu protrombinazy, zwiększone wytwarzanie aktywnej trombiny i dalsza aktywacja czynników V i VIII w wyniku dodatniego sprzężenia zwrotnego. Powoduje to powstanie stanu nadkrzepliwości [Orban i wsp., 2005, Segers i wsp., 2007].
Gen kodujący FV ma długość 80 kilo par zasad, składa się z 25 eksonów, 24 intronów i położony jest na chromosomie 1 (1q21-q25). Do tej pory opisano mutacje mogące być przyczyną powikłań zakrzepowych, jak również obniżenia stężenia i aktywności FV ze skłonnością do powikłań krwotocznych.
Częstość występowania czynnika V Leiden w populacji ogólnej rasy kaukaskiej oceniana jest w większości badań na 5-8% [Rees i wsp., 1999, Ridker i wsp., 1997]. Obecność wariantu heterozygotycznego 1691GA podnosi ryzyko wystąpienia powikłań zakrzepowych 4-8 razy. U homozygot ryzyko zakrzepicy wzrasta o nawet około 80 razy. Sugeruje się, że zaburzenia naczyniowe w łożysku mogą być spowodowane nieprawidłowościami wynikającymi z obecności zmutowanych wariantów czynnika V Leiden [Ament i wsp., 2003]. Oprócz znanych powikłań związanych z nosicielstwem czynnika V Leiden obserwowano również związek pomiędzy nosicielstwem czynnika V Leiden u matki a wystąpieniem udaru u płodu lub noworodka [Calderwood i wsp., 2005].
Mutacja praktycznie prawie wcale nie występuje u Azjatów, Afrykanów oraz rdzennej ludności australijskiej (Aborygeni). Ryzyko wystąpienia powikłań zakrzepowych znacząco wzrasta wśród osób nosicieli mutacji Leiden (genotyp 1691GA oraz 1691AA). W przeprowadzonych do tej pory badaniach odnotowano 2-7 krotny wzrost ryzyka zakrzepicy przy obecności jednego zmutowanego allela 1691A, natomiast obecność dwóch zmutowanych alleli 1691A podnosi to ryzyko aż o 40-80, a nawet 100 razy. Istnieją sugestie, że pojawienie się mutacji Leiden w genie FV było swoistym krokiem w ewolucji prowadzącym do zmniejszenia utraty krwi podczas porodu [Zivelin i wsp., 2006].
Warto wspomnieć o istnieniu innych patologicznych wariantów FV, które przyczyniają się do wystąpienia stanu nadkrzepliwości. Są one spowodowane m. in. obecnością mutacji punktowej 1090G>C w eksonie 7 (AGG 1090 ACG) genu FV, co powoduje zamianę argininy w pozycji 306 łańcucha białkowego na treoninę (Arg306Thr). Mutacja ta wykryta została w Addenbrooke’s Hospital w Cambridge w Wielkiej Brytanii i nazwana mutacją Cambridge, a wariant FV wykazujący obecność tej zmiany nosi nazwę czynnika V Cambridge. Drugi wariant, mutacja Hong Kong (1090A>G, AGG 1090 GGG), powoduje zmianę w sekwencji białka FV - argininy na glicynę w pozycji 306 (Arg306Gly). Mutacja ta wykryta została u 3 Chińczyków: 2 pacjentów z głęboką zakrzepicą żylną oraz u 1 pacjenta nie wykazującego objawów choroby zakrzepowej [Chan i wsp., 1998]. Obydwie mutacje powodują powstanie oporności na aktywowane białko C, dopiero jednak przyszłe badania wyjaśnią właściwe znaczenie tych polimorfizmów w aktywności prozakrzepowej. Inna mutacja 4070A>G w genie czynnika V powoduje zamianę aminokwasu histydyny na argininę (His1299Arg) i znana jest pod nazwą haplotypu R2. U nosicieli tej formy mutacji spostrzeżono łagodnego stopnia oporność na APC oraz wzrost ryzyka wystąpienia zakrzepicy, szczególnie u pacjentów będących jednocześnie nosicielami mutacji Leiden (ryc. 2).
Polimorfizm zamiany pojedynczego nukleotydu 1328C>T (M395T, rs6033) polega na zamianie tyminy na cytozynę w eksonie 8 genu kodującego czynnik V krzepniecia. Substytucja nukleotydowa powoduje zamianę aminokwasu w łańcuchu ciążkim białka czynnika V (w pozycji 385 łańcucha białkowego następuje zamiana aminokwasu metioniny na treoniny), co bezpośrednio wpływa na generację trombiny. Polimorfizm ten prawdopodobnie związany jest ze zwiększeniem oporności na aktywowane bialko C. Stosunkowo niewiele badań dotyczy związku tego polimorfizmu z występowaniem powikłań w ciąży. Wykazano korelację wariantu 1328C>T FV z przedwczesnym oddzieleniem łożyska oraz stanem przedrzucawkowym, szczególnie z jego ciężką postacią [Watanbae i wsp., 2002, Faisel i wsp., 2004, Jaaskelainen i wsp., 2004] (ryc 2).
Rycina 2. Schemat genu czynnika krzepnięcia V Leiden.
Znaczenie mutacji Leiden V czynnika krzepnięcia w położnictwie
W ostatnich latach wskazano na związek występowania trombofilii z pojawianiem się szeregu powikłań w czasie trwania ciąży tj. występowaniem żylnej choroby zakrzepowo-zatorowej (VTE – venous thromboembolism) u kobiet ciężarnych, poronień nawracających, wewnątrzmacicznego ograniczenia wzrastania płodu, utraty ciąży w II oraz późnym III trymestrze ciąży, przedwczesnego oddzielenia łożyska oraz stanu przedrzucawkowego/rzucawki. Podstawową hipotezą łączącą wrodzone trombofilie z występowaniem powyższych powikłań w ciąży jest obserwacja, że stymulacja układu krzepnięcia spowodowana dysfunkcją endotelium łatwiej ujawnia się u kobiet z defektami uwarunkowanymi genetycznie w zakresie kaskady krzepnięcia, predysponującymi do powikłań zakrzepowych w krążeniu łożyskowym [Carp i wsp., 2002, Cao i wsp., 2013b]. Występowanie tych powikłań prawdopodobnie uwarunkowane jest nieprawidłowym rozwojem łożyska z nieadekwatną perfuzją łożyskową. Tendencja prozakrzepowa może manifestować się jako „zakrzepowe uszkodzenie” krążenia łożyskowego. Zmiany te obecnie określane są w literaturze skrótem PVC (pregnancy vascular complications) [Greer i wsp., 2003, Kupferminc, 2005].
Od dawno wiadomo, że sama ciąża jest stanem sprzyjającym powstawaniu „fizjologicznej nadkrzepliwości”. Przy dodatkowej obecności defektów genetycznych związanych z kaskadą krzepnięcia i nasileniem procesu wykrzepiania, w sprzyjających warunkach, może dojść do powstania poważnych powikłań u kobiet ciężarnych, co wpływa