Chemia roztworów
Dr Urszula Lelek-Borkowska
ROZTWORY
Roztwór – homogeniczna mieszanina składająca się z jednej lub
więcej substancji rozpuszczonych w rozpuszczalniku
Rodzaj
mieszaniny roztwór koloid zawiesina
homogeniczność homogeniczny heterogeniczny heterogeniczny
rozmiar
Rodzaje roztworów
substancja rozpuszczona słodkie napoje wódka etanol napoje gazowane CO ciecz dym popiół w powietrzu wilgoć woda w powietrzu powietrze O2 i inne gazy w N2 gaz ciało stałe ciecz gaz usz czalnikKOLOIDY
Koloid fazowy – składa się z fazy ciągłej, czyli substancji
rozpraszającej, zwanej też ośrodkiem dyspersyjnym lub dyspergującym i nierozpuszczalnej w nim fazy rozproszonej, czyli substancji zdyspergowanej. Cząstki rozproszone w cieczy lub gazie – zole.
Koloid cząsteczkowy - fazą rozproszoną są makrocząsteczki, na
przykład polimery (żelatyna, skrobia, białka) – nie występuje wówczas wyraźna granica fazowa, bo cząsteczki rozpuszczalnika mogą wnikać do wewnątrz makrocząsteczki.
Rodzaje koloidów
faza zdyspergowana zawiesina kolidalna emulsja piana ciecz aerozol stały aerozol ciekły - gaz ciało stałe ciecz gaz sp er gu ją cakoagulacja – zjawisko łączenia się cząstek fazy rozproszonej
koloidu w większe zespoły tworzące nieregularną sieć (koagulat) (przejście zolu w żel)
peptyzacja – zjawisko odwrotne do koagulacji (żel w zol)
denaturacja – nieodwracalny proces przechodzenia zolu w żel
Własności koloidów
peptyzacja koagulacja
9
STĘŻENIA
Stężenie podaje skład roztworu
• procent wagowy, stężenie procentowe (%w, Cp), • procent objętościowy (%vol),
• ułamek molowy (xi), • stężenie molowe (Cm), • stężenie normalne (CN).
Procent wagowy (stężenie procentowe) – podaje ilość
jednostek wagowych (np. gramów) substancji rozpuszczonej w 100 jednostkach (gramach) wagowych roztworu.
100
%
%
m
m
m
%
100
m
m
C
%
s rozp s ru r s p w
%w – procent wagowy Cp – stężenie procentowe,11
Obliczyć stężenie procentowe roztworu przygotowanego przez rozpuszczenie 25g NaCl w 150g wody.
Dane: ms=25g, mrozp=150g. Rozwiązanie:
%
28
,
14
%
100
g
175
g
25
%
100
g
150
g
25
g
25
%
w
Procent objętościowy – podaje ilość jednostek objętości
substancji rozpuszczonej w 100 jednostkach objętości roztworu.
%
%
100
v
v
v
%
100
v
v
%
s rozp s ru r s v
%v – procent objętościowy,13
Jaki jest procent objętościowy roztworu, jeżeli 40cm3 etanolu
rozpuszczono w 60cm3 wody? Dane: vs= 40cm3, vrozp = 60cm3
.
Rozwiązanie: % 40 % 100 cm 100 cm 40 % 100 cm 60 cm 40 cm 40 % 3 3 3 3 3 v Przykład:Ułamek molowy – podaje stosunek ilości moli jednego ze
składników do sumy ilości moli wszystkich składników w roztworze
.
i 2 1 s i i s sn
n
n
n
n
...
n
x
xs – ułamek molowy,kwas żołądkowy 0,1 M HCl
15 Stężenie molowe – podaje ilość moli substancji rozpuszczonej
w 1dm3 roztworu.
3 s s Mdm
mol
v
M
m
v
n
C
CM – stężenie molowe,n –ilość moli substancji rozpuszczonej, v – objętość roztworu,
ms – masa substancji rozpuszczonej,
Stężenie normalne – podaje ilość gramorównoważników
substancji rozpuszczonej w 1dm3 roztworu.
3 s s s Ndm
wal
v
G
m
v
g
C
CN – stężenie normalne,17 Gramorównoważnik – ilość gramów substancji powiązana z
oddaniem lub przyjęciem jednego mola, elektronów. Inaczej – masa molowa podzielona przez ogólną wartościowość dodatnią lub ujemną
.
wal g 2 M G SO H s s 4 2
wal
g
3
M
G
PO
H
s s 4 3Kwasy – gramorównoważnik jest równy masie molowej
wal g 2 M G ) OH ( Ca s s 2 wal g 3 M G ) OH ( Al s s 3
Wodorotlenki – gramorównoważnik jest równy masie molowej
podzielonej przez ilość grup wodorotlenowych
.
Sole – gramorównoważnik jest równy masie molowej podzielonej
przez ilość atomów metalu pomnożoną przez jego wartościowość.
g M
19
ROZPUSZCZANIE
REAKCJA
SOLWATACJA DYSPERSJA
Rozpuszczanie w wyniku reakcji
Rozpuszczająca się substancja reaguje z cząsteczkami rozpuszczalnika lub innej, wcześniej rozpuszczonej substancji, tworząc nowy związek chemiczny.
H
ZnCl
HCl
2
Zn
3
2
2
2
H
O
H
CO
CO
4 3 2 5 2O
3
H
O
2
H
PO
P
21
Rozpuszczanie w wyniku solwatacji
Solwatacja (hydratacja) – polega na otaczaniu cząsteczek
rozpuszczającej się substancji przez cząsteczki rozpuszczalnika (wody).
Rozpuszczanie w wyniku dyspersji
Dyspersja – mieszanie się dwóch substancji w wyniku dyfuzji i
23
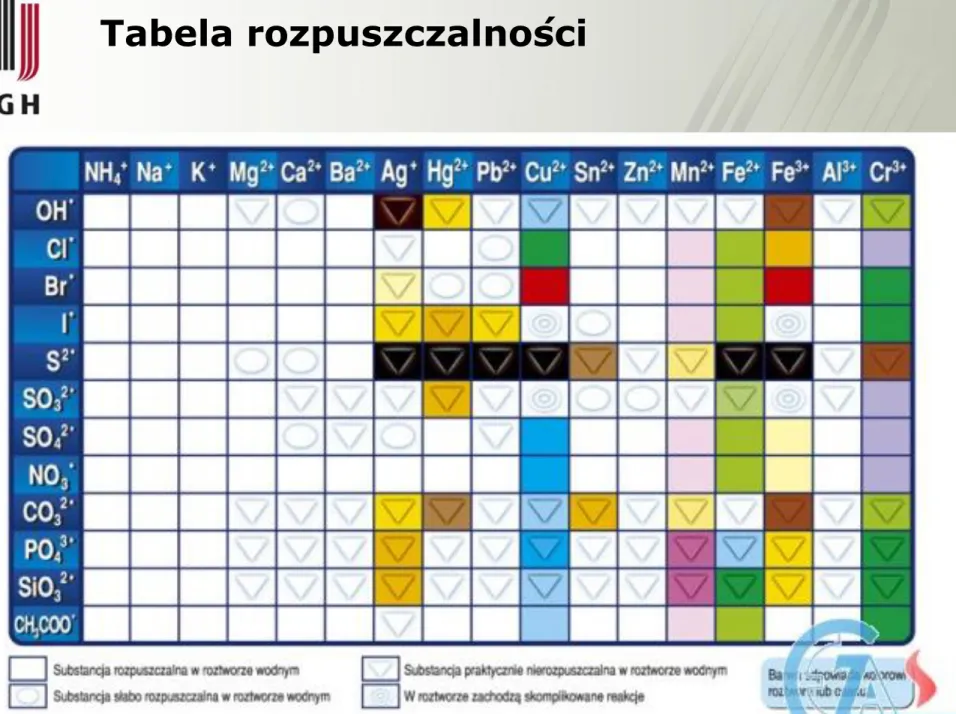
Rozpuszczalność
Rozpuszczalność – ilość substancji rozpuszczonej w
określonym rozpuszczalniku w określonych warunkach temperatury i ciśnienia.
Roztwór w stanie równowagi z osadem (taki, w którym nie można rozpuścić więcej substancji) nazywamy nasyconym.
Maksymalną rozpuszczalność często wyraża się jako
maksymalne stężenie (stężenie roztworu nasyconego) i wyraża się w gramach na 100 g rozpuszczalnika
.
g
100
g
m
m
s
rozp s s ss – rozpuszczalność,25
Wpływ temperatury na rozpuszczalność
Wpływ temperatury zależny jest od efektu cieplnego procesu rozpuszczania: H<0 T - s, H>0 T - s.
Wpływ ciśnienia na rozpuszczalność
Prawo Henry’ego:
W stałej temperaturze ilość rozpuszczonego gazu jest proporcjonalna do ciśnienia cząstkowego gazu w równowadze z cieczą.
i
i
k
x
27
Fizykochemiczne właściwości roztworów
siły międzycząsteczkowe
A-B = A-A i B-B
siły międzycząsteczkoweA-B > A-A i B-B
roztwory
doskonałe
rzeczywiste
A B
Roztwory doskonałe i rzeczywiste
Roztwór
doskonały rzeczywisty Roztwór
oddziaływania
międzycząsteczkowe A-B =A-A, B-B A-B> A-A, B-B entalpia tworzenia H 0 H 0
efekt objętościowy nie występuje występuje
29
Prężność par nad roztworem
Prawo Raoulta – ciśnienie par
prawo Raoulta – ciśnienie cząstkowe par składnika nad
roztworem jest proporcjonalne do ciśnienia, jakie wykazywałby czysty składnik oraz jego ułamka molowego.
i 0
i
i
p
x
p
pi – ciśnienie pary składnika „i”, p0
i – ciśnienie par nad czystym składnikiem „i”,
i i 0 ix
p
p
31
Zależność ciśnienia par składników nad roztworem od składu roztworu idealnego.
Krzepnięcie
Temperatura krzepnięcia – temperatura, w której fazy ciekła
i stała są ze sobą w równowadze. Przy odpowiedniej czystości substancji schładzanej i pod pewnymi warunkami jest możliwe schłodzenie substancji w postaci ciekłej poniżej jej temperatury krzepnięcia. Ciecz taka nosi nazwę cieczy przechłodzonej.
Wrzenie
Temperatura wrzenia – temperatura, przy której ciśnienie
powstającej pary (ciśnienie pary nasyconej) jest równe ciśnieniu otoczenia, skutkiem czego parowanie następuje w całej objętości cieczy (dana substancja wrze).
Temperatura wrzenia i krzepnięcia roztworu
Wzrost stężenia roztworu powoduje podniesienie temperatury wrzenia i obniżenie temperatury krzepnięcia
sol s s E m E b
m
M
m
K
C
K
T
sol s s c m c sM
m
m
K
C
K
T
KE – stała ebulioskopowa, C – stężenie molarne,Dyfuzja
Proces dyfuzji – proces polegający na przemieszczaniu się
substancji z obszaru o wyższym stężeniu do obszaru o niższym stężeniu.
41
C
A
D
v
v – prędkość dyfuzji, A – powierzchnia, D – współczynnik dyfuzji, C – gradient stężenia. RT E 0 ae
D
D
D0 – maksymalny współczynnik dyfuzji (dla nieskończonej T), Ea – energia aktywacji,
T – temperatura, R – stała gazowa.
43
Osmoza
Osmoza - dyfuzja cząsteczek rozpuszczalnika przez membranę
półprzepuszczalną, oddzielającą dwa roztwory różniące się potencjałami chemicznymi. Różnica potencjałów chemicznych wynika z różnicy składu (stężenia) roztworów.
Błona półprzepuszczalna musi być przepuszczalna dla rozpuszczalnika, a nieprzepuszczalna dla substancji rozpuszczonej. Proces ten powoduje gradient ciśnienia po obu stronach membrany.
RT
C
Dysocjacja
Dysocjacja – rozpad cząsteczek na jony pod wpływem
rozpuszczalnika. Dysocjujące cząsteczki nazywamy
49
Dysocjacja
m
n
m
n
B
mA
nB
A
m nNaOH
Na
++
OH
-HCl
H
++
Cl
-Al
2(SO
4)
3
2Al
3++ 3SO
Dysocjacja wielostopniowa
Ni(OH)
2
NiOH
++
OH
- sumarycznie:H
3PO
4
3H
++
PO
43-H
3PO
4
H
++
H
2PO
4-H
2PO
4-
H
++
HPO
42-HPO
42-
H
++
PO
43-51 Stopień dysocjacji – zdolność substancji do dysocjacji –
stosunek ilości cząsteczek dysocjujących do ogólnej ilości cząsteczek w roztworze.
0
zd
n
n
nzd – ilość cząsteczek zdysocjowanych,
Elektrolity
mocne
≈ 1
wodorotlenki metali alkalicznych: Li, Na, K,
Rb, Cs, Ca, Sr, Ba, Ra średniej mocy 0.1 < <1 H3PO4, Be(OH)2, Mg(OH)2 słabe < 0.1 H2CO3, H2S, H2SO3, HNO2, kwasy organiczne
53 Stała dysocjacji – stała równowagi reakcji dysocjacji.
m
n
m
n
B
mA
nB
A
m n n mB A n B m A dc
c
c
K
– stężenia jonów, n mB Ac
– stężenie cząsteczek niezdysocjowanych. m n B A
,
c
c
Kd – stała dysocjacji,Prawo rozcieńczeń Ostwalda
Prawo rozcieńczeń Wilhelma Ostwalda podaje zależność
stałej dysocjacji od stopnia dysocjacji i stężenia. prawo to stosuje się wyłącznie do elektrolitów słabych (<0,1).
1
c
K
d
2
55
Aktywność
Aktywność – inaczej stężenie rzeczywiste podaje ilość cząsteczek
w roztworze i oddziaływania pomiędzy nimi.
i
i
i
f
c
a
ai – aktywność składnika „i”,
fi – współczynnik aktywności składnika „i”, ci – stężenie składnika „i”.
Iloczyn rozpuszczalności
Dla trudno rozpuszczalnych soli mianownik w wyrażeniu na stałą dysocjacji można przyjąć za wartość stałą.
, c c c K n mB A n B m A d
c
AmBn
const
.
L – iloczyn rozpuszczalności,
iloczyn stężeń jonów trudno
n
B
m
A
c
c
L
57
2
2
4
4
Ca
SO
CaSO
2 4 2 4Ca
SO
CaSO
c
c
L
Pb
2
I
PbI
2
2
2
I
Pb
PbI
c
c
L
2
2
Iloczyn rozpuszczalności
Wzór rozpuszczalności Iloczyn CaCO3 3,36 · 10-9 PbI2 9,80 · 10-9 AgCl 1,77 · 10-10 BaSO4 1,08 · 10-10 Fe(OH)2 4,87 · 10-17 Hg2Cl2 1,43 · 10-18 CdS 2,51 · 10-2659
Teorie kwasów i zasad
Teoria Arrheniusa
Kwasy – substancje dysocjujące z wydzieleniem jonu H+
(w rzeczywistości jonu hydroniowego H3O+)
Zasady – substancje dysocjujące z wydzieleniem jonu
wodorotlenowego OH-.
nH
O
nH
O
R
n
R
H
kwas
Svante August Arrhenius (1859–1927)Johannes Nicolaus Brønsted (1879–1947)
61
Kwas – donor protonu (H+).
Zasada – akceptor protonu (H+).
Istnieją pary kwasowo–zasadowe
Teoria Brønsteada i Lowry’ego
zasada
H
kwas
OH
H
O
H
2
H
O
H
O
H
3 2
NH
H
NH
4 3 Thomas Martin Lowry (1884–1936)Gilbert Newton
Lewis (1875–1946)
Teoria Lewisa
kwas – akceptor pary elektronowej , zasada – donor pary elektronowej.
3
3
3
3
NH
F
B
NH
BF
63
Podsumowanie teorii kwasów i zasad
teoria kwas przykład zasada przykład
Arrheniusa dysocjuje na wodór
i resztę kwasową H2SO4 2H + +SO 4 2-dysocjuje na anion wodorotlenowy i kation metalu KOH K+ + OH -
Brønsteda-Lowry’ego donor protonu HNO3 + H2O H3O
+ +
NO3- akceptor protonu NH3 + H+ NH4+
Lewisa akceptor pary elektronowej BF3 + NH3 BF3-NH3 elektronowej donor pary AlCl3 + Cl- [AlCl 4]
-Miara kwasowości – pH
OH
H
O
H
2
65
Miara kwasowości – pH
Iloczyn jonowy wody:
14 OH H O H
c
c
10
L
2
log
c
H
pH
0< pH < 14 – skala pH
67 wskaźniki – związki, najczęściej organiczne, które zmieniają
zabarwienie ze zmianą pH.
Pomiar pH
wskaźnik roztwory kwaśne zakres pH zmiany barwy roztwory zasadowe
BBT błękit bromotymolowy 6.0 - 7.8 lakmus 5.0 - 8.0 Oranż metylowy 2.1 - 4.4 Czerwień metylowa 4.2 - 6.0 fenoloftaleina 8.3-10.0 błękit tymolowy 8.0-9.0
papierki wskaźnikowe – bibuła nasączona kilkoma
wskaźnikami, zmieniająca barwę w zależności od wartości pH
69
Zasada działania pH–metru
2
H
e
2
H
2
H0 /H
H H / H2
F
ln
c
RT
E
E
H H / H2
F
log
c
RT
303
.
2
E
pH
059
.
0
E
H
/
H
Hydroliza
Hydroliza – reakcja jonów soli z wodą.
Sole mocnych kwasów i mocnych zasad nie ulegają hydrolizie.
Cl
H
O
Na
OH
H
Cl
Na
2
71
R
nH
O
Me
OH
R
nH
Me
n m 2 n mSale mocnych kwasów i słabych zasad:
2
4
4
2
2
4
4
SO
2
H
O
2
NH
OH
2
H
SO
NH
2
odczyn po hydrolizie kwaśny pH < 7
Sole słabych kwasów i mocnych zasad:
R
H
mOH
Me
O
mH
R
Me
n
m
2
n
m
odczyn po hydrolizie zasadowy pH > 7
73
OH
H
R
Me
O
xH
R
Me
n
m
2
n
m
Sole słabych kwasów i słabych zasad:
S
H
)
OH
(
Fe
O
H
2
S
Fe
2
2
2
2
2
odczyn po hydrolizie obojętny pH 7
Roztwory buforowe
Roztwór buforowy – roztwór, którego pH
prawie się nie zmienia po dodaniu niewielkich ilości mocnego kwasu, czy mocnej zasady.
75 Bufor amonowy, pH = 8-11 - wodorotlenek amonu i jego sól z mocnym
kwasem.
NH
4
+
+ OH
-
NH
4
OH
Bufor octanowy pH = 3,6-5,6 - słaby kwas octowy i jego sól z mocną
zasadą,
CH
3
COOH + OH
-
CH
3
COO
-
+ H
2
O
CH
3
COO
-
+ H
+
CH
3
COOH
www.agh.edu.pl