Lek. med. Agnieszka Koziołek
WPŁYW SPOSOBU ZNIECZULENIA
NOWORODKA Z MASĄ URODZENIOWĄ
NIE PRZEKRACZAJĄCĄ 1000 GRAMÓW DO
ZABIEGU LASEROWEJ FOTOKOAGULACJI
SIATKÓWKI NA WYBRANE PARAMETRY
DOBROSTANU W OKRESIE
OKOŁOOPERACYJNYM
Rozprawa doktorska
Promotor: dr hab. n. med. Michał Gaca
Klinika Anestezjologii w PołoŜnictwie
i Ginekologii, Katedra Anestezjologii i Intensywnej
Terapii Uniwersytetu Medycznego im. Karola
Marcinkowskiego w Poznaniu
Człowiek zajmujący się nauką nigdy nie zrozumie,
dlaczego miałby wierzyć w pewne opinie tylko
dlatego, Ŝe znajdują się one w jakiejś ksiąŜce. [...]
Nigdy równieŜ nie uzna swych własnych wyników
za prawdę ostateczną.
Wykaz skrótów
AEP - Evoked Auriculary Potential (słuchowe potencjały wywołane)
BIS - Bispectral Index (indeks bispektralny) BP – Blood Pressure (ciśnienie krwi) BPD – Bronchopulmonary Dysplasia (dysplazja oskrzelowo – płucna) etCO2 – end-expiratory carbon dioxide (końcowowydechowe stężenie dwutlenku węgla)
DBP – Diastolic Blood Pressure (rozkurczowe ciśnienie krwi) EUROSTAT – Europejski Urząd Statystyczny przy Komisji Europejskiej FiO2 – stężenie tlenu w mieszaninie oddechowej HR – Heart Rate (czynność serca)
FN – fentanyl
GPSK - 3 – Ginekologiczno - Położniczy Szpital Kliniczny nr 3 w Poznaniu HRV – Heart Rate Variability (zmienność rytmu serca)
IF – Infant Flow
IMV – Intermittent Mandatory Ventillation (przerywana wentylacja obowiązkowa) IVH – Intraventricular Hemorrhage (krwotok do komór mózgu) LTV – Long Term Variability
MAC – Minimal Alveolar Concentration (minimalne stężenie pęcherzykowe) MAP – Medium Arterial Pressure (średnie ciśnienie tętnicze)
NCPAP – Nasal Continuous Positive Airway Pressure (ciągłe dodatnie ciśnienie w drogach oddechowych, donosowe) NICU – Neonatal Intensive Care Unit (oddział intensywnej opieki noworodka)
NIPS - Neonatal Infant Pain Scale (skala oceny bólu)
N-PASS - Neonatal Pain, Agitation and Sedation (skala oceny bólu)
OPS - Objective Pain Scale (skala oceny bólu) OUN – ośrodkowy układ nerwowy
PCV – Pressure Control Ventillation (wentylacja kontrolowana ciśnieniem)
PDA – Patent Ductus Arteriosus (przetrwały przewód tętniczy)
PEEP – Positive End-Expiratory Pressure (dodatnie ciśnienie końcowowydechowe) PIP – Peak Inspiratory Pressure (szczytowe cisnienie wdechowe)
pNN50% - odsetek różnic pomiędzy interwałami RR, które przekraczają 50 ms [%])
Pwd – ciśnienie wdechowe
RMS_SD - root mean square of successive differences
ROP – Retinopathy of Prematurity (retinopatia wcześniacza)
RR – Respiratory Rate (częstość oddechów); również: odstęp między załamkami R w EKG SBP – Systolic Blood Pressure (skurczowe ciśnienie krwi)
STV – Short Term Variability t.c. – tydzień ciąży
TIVA – Total Intravenous Anesthesia (znieczulenie ogólne całkowicie dożylne)
UE – Unia Europejska Vol% - Volumen %
WHO – World Health Organization (Światowa Organizacja Zdrowia)
WZF Polfa – Warszawskie Zakłady Farmaceutyczne Polfa
Badania medyczne zrobiły tak niebywały postęp, że dziś praktycznie nie ma już ani jednego zdrowego człowieka. Aldous Huxley
1. WSTĘP
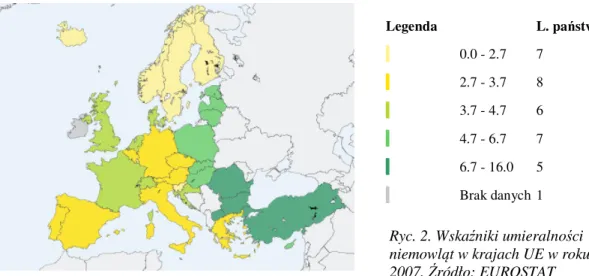
Miarą postępu i rozwoju nauk medycznych na przestrzeni wieków jest to, w jaki sposób te nauki przyczyniają się do zmniejszenia śmiertelności w populacji ludzkiej. Jednym ze wskaźników, który często jest stosowany dla oceny poziomu rozwoju danego państwa lub regionu jest wskaźnik umieralności niemowląt (liczba zgonów niemowląt w stosunku do 1000 żywo urodzonych). Generalnie, największa wartość tego współczynnika jest notowana w ubogich krajach Afryki i Azji, najmniejsza zaś w Ameryce Północnej, Australii, Europie i wysoko rozwiniętych państwach Azji (np. Japonia, Singapur).1
Ryc. 1. Umieralność niemowląt na świecie w roku 2007. Źródło: Wikipedia na podstawie Central Intelligence Bureau: Rank Order – Infant mortality rate (ang.). W: The World Factbook [on-line]. 2008-12-18
Według bazy danych EUROSTATu (Europejski Urząd Statystyczny przy Komisji Europejskiej; przy czym najnowsze dostępne dane dotyczą lat 2007 – 2008) na obszarze obecnych 27 krajów członkowskich Unii Europejskiej wskaźnik ten spada systematycznie – od około 6,8 w roku 1997 do 4,7 w roku 2007, zaś w Polsce odpowiednio z 10,2 do 6,02. Poniższa mapa obrazuje wskaźniki umieralności niemowląt w poszczególnych krajach UE w roku 2007:
Zgodnie z danymi z tej samej bazy EUROSTATu, umieralność okołoporodowa (określona jako liczba urodzeń martwych płodów powyżej 1000 g masy ciała oraz zgonów przed upływem 6 dni po porodzie, na 1000 urodzeń żywych) w krajach europejskich wahała się od 18,3 (Macedonia) do 5,4 (Szwecja) w roku 1997, zaś w roku 2006 od 15,2 (Macedonia) do 3,3 (Luksemburg). Polska w tym zestawieniu mieści się pośrodku: wskaźnik umieralności okołoporodowej oscylował między
10,8 w 1999 a 6,8 w 2006 roku. Głównymi przyczynami umieralności niemowląt są (zarówno w Polsce, jak i Europie Zachodniej) wady rozwojowe oraz stany chorobowe powstałe w okresie okołoporodowym (łącznie ok. 82% przyczyn zgonów noworodków w UE).
Jako miarę stanu zdrowia nowo narodzonych dzieci, jak i jakości opieki perinatalnej często stosuje się odsetek żywych urodzeń noworodków z masą urodzeniową powyżej
Legenda L. państw 0.0 - 2.7 7 2.7 - 3.7 8 3.7 - 4.7 6 4.7 - 6.7 7 6.7 - 16.0 5 Brak danych 1 Terminologia wg WHO3
noworodek z niską masą urodzeniową < 2500 g noworodek z bardzo niską masą urodzeniową < 1500 g noworodek ze skrajnie niską masą urodzeniową < 1000 g Wcześniactwo: wiek ciąŜowy <37 tygodni
Skrajne wcześniactwo: wiek ciąŜowy < 28 tygodni
Ryc. 2. Wskaźniki umieralności niemowląt w krajach UE w roku 2007. Źródło: EUROSTAT
Tabela 1. Terminologia dotycząca wcześniactwa według WHO
2500 g (zgodnie z terminologią wg WHO3, tabela 1). I tak, na obszarze 27 obecnych państw członkowskich UE w roku 1999 wynosił on 93,2% a w roku 2008 – 92,9%. W Polsce było to odpowiednio: 94% i 93,9%.
Powyższe dane podano w celu uzmysłowienia sobie, jak dynamiczny postęp w opiece zdrowotnej dokonuje się z roku na rok, i skoro coraz więcej noworodków przeżywa (co więcej – są to coraz mniejsze noworodki), zapewne możemy spodziewać się, że kierunek opieki perinatalnej będzie w jeszcze większym stopniu zorientowany na najmniejszych, najbardziej niedojrzałych pacjentów.
Problem zwiększenia przeżywalności nie jest jedynym celem opieki zdrowotnej – gdyż „najważniejsze w medycynie nie jest uratowanie od śmierci, lecz wyleczenie z
choroby”. Niestety, wraz z postępem medycyny i zwiększaniem się szans na przeżycie noworodków, które w normalnych warunkach nie są dostatecznie dojrzałe do samodzielnego życia, stajemy przed problemem opieki nad pacjentem, którego przeżycie uzależnione jest od wysokospecjalistycznego leczenia ale jednocześnie leczenie to pozostawia po sobie szereg następstw, wymagających dalszego leczenia, rehabilitacji, specjalistycznej opieki… która z całą pewnością nie kończy się w momencie wypisu ze szpitala!
Niniejsza rozprawa doktorska dotyczy właśnie takich pacjentów – wcześniaków i „byłych wcześniaków”, u których jednym z wielu następstw, zarówno wcześniactwa jak i związanych z tym powikłań i ich leczenia, jest retinopatia – ciężkie schorzenie zagrażające utratą wzroku. Co więcej, konieczność leczenia operacyjnego tych dzieci wymusza również zapewnienie ochrony przed bólem, stresem okołooperacyjnym i ogólnoustrojowymi powikłaniami. Zadanie to należy do współpracującego z zespołem neonatologicznym i okulistycznym lekarza anestezjologa, który powinien zdawać sobie sprawę, że podejmuje się opieki nad chorym znacznie zwiększonego ryzyka – bardzo małym, nie w pełni dojrzałym i nie w pełni zdrowym.
Poniżej omówiono najważniejsze aspekty kliniczne i farmakologiczne związane z postępowaniem anestezjologicznym i leczeniem bólu u przedwcześnie urodzonych noworodków.
1.1. Retinopatia wcześniaków 1.1.1. Istota choroby
zastosowana w Japonii w latach 60. Związek powstawania tej choroby z terapeutycznym stosowaniem tlenu został ustalony w 1984 roku (Patz i wsp.).
U podłoża schorzenia leży nieprawidłowa proliferacja naczyń siatkówki (postępujący skurcz naczyń, neowaskularyzacja oraz włókniste zbliznowacenie). W warunkach prawidłowych, rozwój naczyń siatkówki przebiega od tarczy nerwu wzrokowego na zewnątrz, tj. do rąbka zębatego siatkówki. Czynniki uszkadzające, takie jak niedotlenienie wewnątrzmaciczne, mogą zaburzyć ten rozwój na różnych etapach.
Zmiany te prowadzić mogą do krwawień do siatkówki, jej obrzęku, zwłóknienia lub odwarstwienia, uszkodzenia drogi wzrokowej a w konsekwencji do ślepoty dziecka. Częstość występowania wszystkich postaci ROP (badania przeprowadzone w latach 2000 – 2002 wśród 6998 noworodków w 26 ośrodkach w USA, ETROP study4) określono na 68% u pacjentów z masą ciała poniżej 1251 gramów, przy czym aż 92,7% u noworodków z masą poniżej 750 gramów, 75,8% u noworodków z masą ciała 751-999 gramów, 89% u pacjentów urodzonych poniżej 27 tygodnia ciąży i 51,7% między 28 a 31 tygodniem ciąży.
W polskich badaniach z lat 2002 – 2003 (Gotz – Więckowska A. i wsp.5) opartych na materiale z regionu Wielkopolski częstość występowania ROP u noworodków z masą poniżej 1250 g określono się na 32,6%, zaś powyżej 1250 gramów – 7,4%.
1.1.2 Klasyfikacja zmian
The International Classification of Retinopathy of Prematurity Revisited (2005) opisuje następujące stadia choroby6:
Stopień I – linia demarkacyjna między unaczynionym a nieunaczynionym obszarem siatkówki;
Stopień II – wał („grzebień”) włóknisto – naczyniowej tkanki na granicy nieunaczynionej i unaczynionej siatkówki;
Stopień III – włóknisto – naczyniowe pozasiatkówkowe proliferacje;
Stopień IV – zwłóknienie i zbliznowacenie oraz częściowe odwarstwienie siatkówki; Stopień V – całkowite odwarstwienie siatkówki.
1.1.3. Czynniki ryzyka
Najsilniejszym czynnikiem ryzyka jest wcześniactwo (wiek urodzeniowy i masa ciała). Do pozostałych czynników ryzyka zaliczają się: rasa kaukaska, niedotlenienie,
bezdech, posocznica, hipo- i hiperkapnia, krwawienie dokomorowe, anemia, kwasica mleczanowa i ciąża mnoga.
Związek z terapeutycznym stosowaniem tlenu, choć potwierdzony, nie określa jednak, jakie stężenia tlenu są bezpieczne. Pierwsza „epidemia” ROP w latach 40. XX wieku zakończyła się wraz z zastosowaniem bardziej restrykcyjnej terapii tlenem, druga – która pojawiła się w latach 60. – trwała do późnych lat 90. i najprawdopodobniej związana była również (a może przede wszystkim) z ogromnym wzrostem przeżywalności wśród wcześniaków z najmniejszą masą ciała.
1.1.4. Badania przesiewowe wśród noworodków z grupy ryzyka i wskazania do leczenia zabiegowego
American Academy of Pediatrics w wytycznych z 2006 roku zaleca przeprowadzanie okulistycznych badań przesiewowych u wszystkich noworodków urodzonych poniżej 30 tygodnia ciąży, lub z masą ciała przy urodzeniu niższą niż 1500 gramów. U wcześniaków poniżej ukończonego 27 tygodnia ciąży badanie to przeprowadzić należy w 31 tygodniu wieku postkoncepcyjnego, zaś u starszych – w 4 tygodniu życia7.
Polskie Wytyczne Krajowego Zespołu Specjalistycznego w dziedzinie Pediatrii i Medycyny Szkolnej z dnia 15 grudnia 1992 r. w sprawie powszechnych profilaktycznych badań medycznych noworodków, niemowląt i dzieci w wieku 2 lat zalecają przeprowadzanie takich badań w 4, 8 i 12 tygodniu życia u każdego noworodka urodzonego przed 36 tygodniem ciąży, a następnie w 1. roku życia8.
W części przypadków choroba może cofnąć się samoistnie. Suplementacja witamin A i E oraz zmniejszenie intensywności oświetlenia mogą wpłynąć na zahamowanie postępu choroby. Jednakże przy wczesnym wystąpieniu zmian (szczególnie zlokalizowanych w tylnym biegunie siatkówki) i szybko postępującej chorobie należy rozważyć leczenie operacyjne. Wskazaniami do takiego leczenia są: - zmiany typu „plus” (tj. nieprawidłowa proliferacja, pogrubienie i kręty przebieg naczyń w biegunie tylnym siatkówki w co najmniej dwóch kwadrantach) w strefie I (wokół tarczy nerwu wzrokowego), niezależnie od stopnia choroby;
- ROP 3°;
- ROP 2° lub 3° ze zmianami typu „plus” w strefie II.
Tabela 2. Problemy skrajnego wcześniactwa11
diodowym lub argonowym). Zabieg polega na punktowej, laserowej koagulacji nieunaczynionych obszarów siatkówki, co ma zapobiec dalszemu nieprawidłowemu rozplemowi naczyń i postępowi choroby.
Wieloośrodkowe badania dotyczące długoterminowych wyników leczenia (po 10 i 15 latach od zabiegu, badanie CRYO-ROP9,10) potwierdzają niemal dwukrotne zmniejszenie częstości występowania odwarstwienia siatkówki (w porównaniu do grupy kontrolnej, nie leczonej) oraz o blisko 1/3 rzadsze występowanie obniżonej ostrości wzroku.
1. Niewydolność oddechowa:
- długotrwała wentylacja mechaniczna i tlenoterapia,
- stymulacja dojrzałości płuc za pomocą steroidów i surfaktantu,
- powikłania: dysplazja oskrzelowo – płucna, trudność w uzyskaniu samodzielnej wentylacji, tlenozaleŜność. 2. Układ krąŜenia:
- niedojrzałe mechanizmy regulacji ciśnienia krwi i przepływów tkankowych (na poziomie receptorowym i ośrodkowym, oraz endokrynnym),
- zwiększona wraŜliwość kanałów wapniowych w obrębie myocardium
- serce noworodka bardziej podatne na depresyjne działanie anestetyków wziewnych i opioidów - często przetrwały przewód tętniczy Botalla, niekiedy wymagający pilnej interwencji chirurgicznej. 3. Ośrodkowy układ nerwowy:
- niedojrzałe mechanizmy autoregulacji przepływów mózgowych, - wraŜliwość na wahania ciśnienia tętniczego i śródczaszkowego, hipoksję
- wraŜliwość splotów naczyniówkowych komór mózgu na pękanie - ryzyko krwawień do komór mózgu - retinopatia wcześniaków i uszkodzenie drogi wzrokowej jako przyczyna ślepoty
4. Ból:
- jest pewne, iŜ noworodek moŜe odczuwać ból,
- drogi przewodzenia bólu i mechanizmy nocycepcji nie są jeszcze w pełni rozwinięte,
- neurony czuciowe w rdzeniu kręgowym są wykształcone w 6 tygodniu Ŝycia płodowego, a przed upływem 24 tygodni obecne są juŜ rdzeniowe drogi przewodzenia bólu.
- bodźce bólowe wywołują szereg potencjalnie szkodliwych następstw, w tym nasiloną reakcję stresową organizmu wyraŜoną objawami krąŜeniowymi, oddechowymi, neurologicznymi i endokrynnymi. - objawy reakcji bólowej mogą być niespecyficzne, często słabo wyraŜone lub trudne do rozpoznania. 5. Przewód pokarmowy:
– niedroŜność jelit (na róŜnych piętrach), omphalocele, wytrzewienie, martwicze zapalenie jelit - niekiedy konieczność pilnej interwencji chirurgicznej (perforacja przewodu pokarmowego, zapalenie otrzewnej) - powodują znaczne zaburzenia gospodarki wodno – elektrolitowej – mogą być zagraŜające Ŝyciu! 6. Metabolizm:
- niedojrzałość wątroby i nerek - osłabiona eliminacja potencjalnie szkodliwych metabolitów, długi czas działania leków, tendencja do kumulacji
7. Termoregulacja:
- niedojrzałe mechanizmy termoregulacji
- opóźniona reakcja na zmiany temperatury otoczenia
- brak moŜliwości utrzymania normotermii właściwych dorosłym (termogeneza drŜeniowa, regulacja przepływów naczyniowych w obrębie powłok)
- cienka skóra i tkanka podskórna,
- niekorzystny stosunek powierzchni ciała do masy ciała - zwiększona utrata ciepła
- niezbędne jest zapobieganie hipotermii poprzez aktywne ogrzewanie ciała oraz podawanych płynów. 8. Inne:
- wady wrodzone (w tym wady serca), zespoły genetyczne, niedoŜywienie (słaba przyswajalność składników pokarmowych)
1.2. Kliniczne konsekwencje wcześniactwa ważne dla anestezjologa
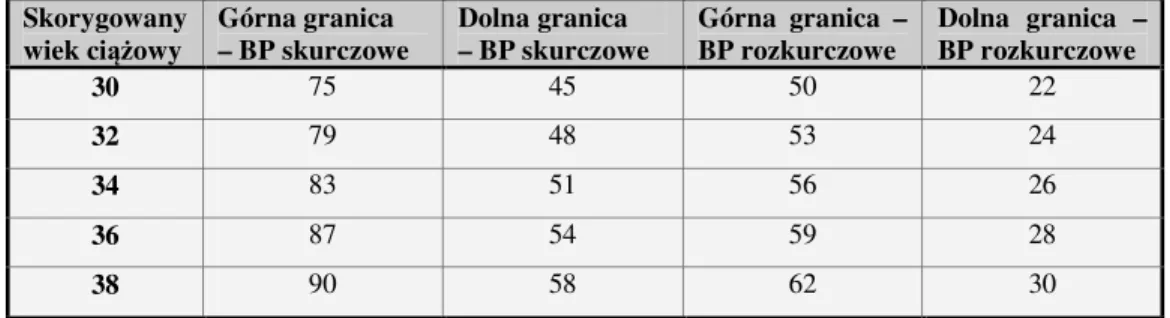
W niniejszej pracy badaną grupę pacjentów stanowiły wcześniaki i byłe wcześniaki ze skrajnie niską masą urodzeniową (w dniu zabiegu między 30-43 tygodniem skorygowanego wieku ciążowego) i w właśnie ich dotyczą powikłania wynikłe z wcześniactwa (bądź skrajnego wcześniactwa) i związanego z tym leczenia.
W Tabeli 2. przedstawiono skrótowo najczęstsze problemy zdrowotne noworodków przedwcześnie urodzonych.
Wszystkie wyżej wymienione problemy dotyczące wcześniaków są dla lekarza anestezjologa równie istotne, szczególnie wtedy, gdy ma styczność z takim pacjentem w pierwszych dobach jego życia. Tym niemniej, z racji tego, że niniejsza rozprawa doktorska dotyczy znieczulenia do zabiegu laserowej fotokoagulacji siatkówki, któremu poddawane są już nieco „starsze” wcześniaki (zazwyczaj między 50 a 80 dobą życia), a sam zabieg jest procedurą o niewielkiej rozległości (anatomicznie) na pierwszy plan wysuwają się kwestie związane z układem oddechowym w okresie okołooperacyjnym, metabolizmem leków i oceną reakcji bólowej.
1.2.1. Dysplazja oskrzelowo - płucna
Zgodnie z nową definicją, dysplazja oskrzelowo – płucna rozpoznana może być wówczas, gdy spełnione są następujące warunki: tlenozależność w 28 dobie życia (czyli konieczność stosowania tlenoterapii z FiO2 wyższym od atmosferycznego przez co
najmniej 28 dni) i/lub 36 tygodniu wieku postkoncepcyjnego12. Schorzenie to klinicznie może przybierać postacie od łagodnej, poprzez umiarkowaną, do ciężkiej.
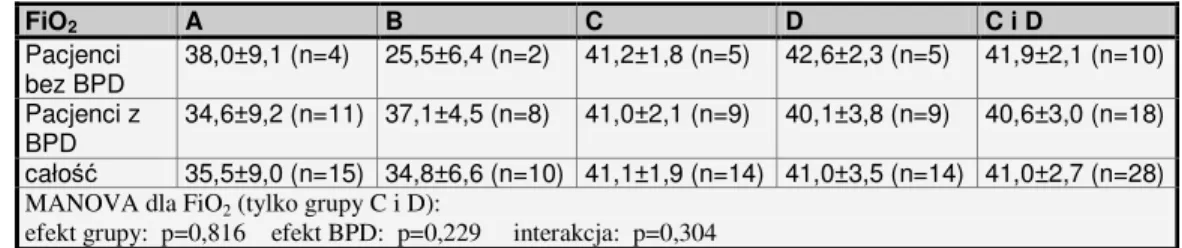
Noworodkami najbardziej narażonymi na wystąpienie dysplazji są wcześniaki urodzone poniżej 32 tygodnia ciąży, szczególnie z niską masą ciała (<1000 g), zaś wśród pozostałych czynników ryzyka wymienia się procesy zapalne, zaburzenia podaży płynów i elektrolitów (głównie sodu), zakażenia, obecność przetrwałego przewodu tętniczego oraz – niekiedy – przedłużone stosowanie mechanicznej wentylacji13.
Z punktu widzenia lekarza anestezjologa, noworodek z dysplazją jest pacjentem podwyższonego ryzyka ze względu na zwiększone prawdopodobieństwo pooperacyjnej niewydolności oddechowej (wydłużony czas wentylacji mechanicznej i tlenoterapii, bezdechy). Dużym problemem może być również nadreaktywność oskrzeli (skurcz oskrzeli i obturacja dróg oddechowych również jako reakcja na zbyt płytką anestezję i analgezję).
1.2.2. Bezdechy
Jednym z powikłań pooperacyjnych jest możliwość wystąpienia epizodów bezdechów (jako bezdechy patologiczne definiuje się brak oddechu dłuższy niż 20 sekund oraz z towarzyszącą bradykardią14). Szczególnie podatne na bezdechy są wcześniaki (im niższy tzw. skorygowany wiek ciążowy oraz im większa niedojrzałość neurologiczna tym większe jest tego prawdopodobieństwo). Do pozostałych czynników ryzyka należą bezdechy występujące przed zabiegiem, dysplazja oskrzelowo – płucna, zakażenie, hipoglikemia, niedokrwistość oraz czynniki neurologiczne (krwawienia do komór mózgu, drgawki, niedotlenienie okołoporodowe, anomalie tętniczo-żylne w obrębie OUN, ośrodkowy zespół hipowentylacji). Nie bez znaczenia są też leki podane noworodkowi – w szczególności opioidy, benzodiazepiny i barbiturany.
Wyróżnia się trzy typy bezdechów: centralne, obturacyjne i mieszane – najczęstsze.
Profilaktyczne podawanie metyloksantyn (kofeiny, aminofiliny, teofiliny) jest jedną z najpopularniejszych obecnie stosowanych metod, zwłaszcza że podawane przed planowanym odstawieniem wentylacji mechanicznej noworodka mogą zmniejszyć ryzyko niepowodzenia ekstubacji15. Metaanaliza z 2004 roku (Eichenwald/Aina/Stark)16, jak również inne publikacje jako skuteczny i stosunkowo mało toksyczny polecają cytrynian kofeiny17-20. Lekiem drugiego rzutu jest doksapram. Do niefarmakologicznych sposobów leczenia bezdechów należą m.in. tlenoterapia bierna, stymulacja bodźcami dotykowymi, wysokie ułożenie dziecka (pozycja na brzuchu), obniżenie temperatury otoczenia, a w wypadku nieskuteczności leczenia rozważenie wsparcia oddechu metodą NCPAP lub – w dalszej kolejności – wentylacji mechanicznej.
Monitorowanie czynności serca i oddechu w okresie pooperacyjnym jest w tej sytuacji koniecznością.
1.2.3. Zaburzenia glikemii
Zaburzenia gospodarki węglowodanowej u wcześniaków są dość częstym problemem. Szczególnie wyraźnie zaznacza się tendencja do hipoglikemii, dlatego też należy zwracać uwagę na zapewnienie dostatecznej podaży glukozy w ciągu całego okresu okołooperacyjnego (płyny infuzyjne przetaczane podczas operacji koniecznie muszą w swoim składzie zawierać glukozę) oraz monitorowanie poziomu glikemii.
Hiperglikemia natomiast może pojawiać się w okresie okołooperacyjnym jako wyraz nasilonej reakcji stresowej, wywołanej bólem i urazem tkanek21-25. Przyczyną tego stanu jest pobudzenie układu współczulnego, które powoduje wyrzut katecholamin oraz kortyzolu. Innymi czynnikami, które wpływają na podwyższenie poziomu glikemii, będą: nadmierna podaż glukozy, masa ciała poniżej 1500 g, hipotrofia, posocznica, oraz stosowanie leków z grupy metyloksantyn (teofilina, kofeina) oraz hormonów sterydowych (deksametazon)26.
1.3. Ból u noworodka
Pomimo niedojrzałości, jest pewne, iż noworodek może odczuwać ból, choć zarówno drogi jego przewodzenia jak i mechanizmy nocycepcji nie są jeszcze w pełni rozwinięte. Neurony czuciowe w rdzeniu kręgowym są wykształcone w 6 tygodniu życia płodowego, a przed upływem 24 tygodni obecne są już rdzeniowe drogi przewodzenia bólu. Tak samo jak u dorosłego, bodźce bólowe wywołują szereg potencjalnie szkodliwych następstw, w tym nasiloną reakcję współczulną organizmu w odpowiedzi na stres wyrażoną objawami krążeniowymi, oddechowymi, neurologicznymi i endokrynnymi27-29. Do najbardziej typowych i zauważalnych (bądź mierzalnych) wykładników reakcji na ból należą w pierwszej kolejności zmiany behawioralne: pobudzenie, płacz, zmiany mimiki twarzy, reakcja zgięciowa na ból (cofanie kończyny w odpowiedzi na bodziec), przyspieszenie lub zwolnienie czynności serca, wzrost ciśnienia krwi, zmiana rytmu oddychania, obniżenie saturacji krwi a także zmiany metaboliczne: wzrost poziomu katecholamin (adrenaliny, noradrenaliny), kortyzolu, aldosteronu, glukagonu, hormonu wzrostu, beta-endorfin, glukozy, a także wahania poziomu insuliny. Konsekwencją wyżej wspomnianych zmian są: wzrost zapotrzebowania na tlen, wzrost ciśnienia śródczaszkowego, kwasica metaboliczna, powikłania neurologiczne z wystąpieniem krwawienia dokomorowego włącznie.
Objawy reakcji bólowej mogą być niespecyficzne i niekiedy mało obiektywne, i często słabo wyrażone lub trudne do oceny.
1.3.1. Skale oceny bólu i przydatność ich stosowania
W literaturze z zakresu pediatrii i intensywnej terapii dziecięcej można znaleźć wiele różnych narzędzi mających służyć rozpoznaniu i ocenie nasilenia bólu u pacjenta, który nie ma możliwości wyrażenia ich werbalnie.
Wśród najpowszechniej stosowanych skal oceny bólu u noworodków warto wymienić:
• Skala COMFORT – bazuje na ocenie 8 parametrów: świadomości (alertness), nastroju (mood), odpowiedzi oddechowej (respiratory response), aktywności ruchowej (physical movement), średniego ciśnienia tętniczego (MAP), czynności serca
(heart rate), napięcia mięśniowego (muscle tone) oraz grymasu twarzy dziecka (facial
tension)30;
• N-PASS (Neonatal Pain, Agitation and Sedation) – uwzględnia zarówno kryteria behawioralne (crying & irritability, behaviour state, facial expression, extremities
tone), jak i parametry fizjologiczne (vital signs - heart rate, respiratory rate, blood
pressure, saturation31);
• Objective Pain Scale (OPS) – bierze pod uwagę ciśnienie tętnicze krwi (blood
pressure), płacz (crying), ruchy (moving), pobudzenie (agitation) oraz zachowanie dziecka (body language)32,33;
• CRIES – ocenia 5 elementów: płacz (Crying), zapotrzebowanie na tlen (Requires
increased oxygen administration for saturation over 95%), przyspieszenie czynności serca i wzrost ciśnienia tętniczego (Increased vital signs), wyraz twarzy (Expression) oraz stan świadomości (Sleepless)34;
• FLACC (Face, Legs, Activity, Cry, Consolability) – nie uwzględnia parametrów fizjologicznych (ciśnienia, tętna, liczby oddechów)35;
• Premature Infant Pain Profile – uwzględnia parametry fizjologiczne (czynność serca, saturacja), jak i behawioralne, a także wiek ciążowy36;
• NIPS (Neonatal Infant Pain Scale) – opiera się o 6 parametrów: mimika twarzy (facial
expression), płacz (cry), oddychanie (breathing patterns), ruchy kończyn (górnych i dolnych – arms and legs) i stan aktywności (state of arousal)37.
Nietrudno zauważyć, że mimo wielu elementów składających się na ocenę bólu i reakcji stresowej u badanych noworodków, wszystkie te skale zawierają komponentę behawioralną, a więc nie będą przydatne u pacjentów będących pod wpływem leków znieczulenia ogólnego, nieprzytomnych i zaintubowanych. Lekarz anestezjolog zatem informację o nasileniu bólu u noworodka uzyskać może wyłącznie na podstawie parametrów fizjologicznych, zapisu monitora i ewentualnie – na bazie badań laboratoryjnych (ocena poziomu glikemii, adrenaliny, noradrenaliny, poziomu kortyzolu we krwi, i innych hormonów – co oczywiście ze względów technicznych i
ekonomicznych zazwyczaj jest zupełnie nieprzydatne w codziennej praktyce, a poza tym inwazyjne – pobieranie materiału do badań jest bolesną procedurą).
W niniejszej rozprawie doktorskiej podjęto próbę porównania różnych metod znieczulenia opierając się na założeniu, że rutynowo monitorowane parametry życiowe (czynność serca, ciśnienie tętnicze, saturacja) oraz standardowo oznaczane w ramach pooperacyjnych badań gazometrycznych stężenie glukozy we krwi mogą być obiektywnymi wskaźnikami reakcji noworodka na ból i stres, oraz pozwolą ocenić, który ze sposobów analgezji w trakcie i po operacji jest najlepszy aby tę reakcję zminimalizować.
1.4. Problemy znieczulenia noworodka – uwagi ogólne 1.4.1. Organizacja opieki okołooperacyjnej
W zależności od warunków organizacyjnych i lokalowych jednostki zajmującej się leczeniem wcześniaków, zabiegi noworodkowe mogą odbywać się albo w obrębie oddziału noworodkowego (jeśli taki oddział posiada salę operacyjną przystosowaną do ich przeprowadzania), bądź też noworodki są transportowane do najbliższego ośrodka pediatrycznego, który posiada wyspecjalizowany zespół chirurgiczno – anestezjologiczny.
Każda z tych możliwości ma swoje wady i zalety – zabiegi wykonywane w obrębie ośrodka neonatologicznego pozwalają skrócić czas transportu pacjenta do niezbędnego minimum (na salę operacyjną i z powrotem), ale – jeśli neonatologia mieści się na przykład w szpitalu o
profilu położniczym – najczęściej specjalistyczny zespół chirurgiczny dojeżdża na zabiegi z innego ośrodka (a więc nie jest dostępny 24 godziny na dobę przez 7 dni w tygodniu), a i dostęp do dobrze wyszkolonego anestezjologa dziecięcego jest ograniczony (lub znieczula anestezjolog zajmujący się dorosłymi).
1.4.2. Przygotowanie przedoperacyjne
Żelazną zasadą jest: pacjent do zabiegu musi być maksymalnie wyrównany pod Przygotowanie przedoperacyjne
- wywiad;
- wyniki badań laboratoryjnych (niezbędne: grupa krwi, gazometria, poziom glukozy i elektrolitów w surowicy, morfologia krwi obwodowej, niekiedy koagulologia, CRP, białko całkowite, mocznik, kreatynina)
- jeśli noworodek jest niewydolny oddechowo: jakie są parametry wentylacji?
- w zaleŜności od potrzeb i rodzaju interwencji chirurgicznej równieŜ badania obrazowe (RTG klatki piersiowej, USG jamy brzusznej i głowy, tomografia).
Tabela 3. Przygotowanie noworodka do
osoczem, krwinkami płytkowymi itp. – do zabiegów obarczonych ryzykiem utraty krwi) oraz z zapewnionym miejscem opieki pooperacyjnej (monitorowane stanowisko z respiratorem w oddziale intensywnej terapii noworodka).
Konieczne jest obwodowe wkłucie dożylne, niekiedy do tego celu wykorzystać można cewniki w naczyniach pępkowych. Czasem potrzebna jest również kaniulacja żył centralnych oraz tętnic obwodowych (np. w rozległych zabiegach kardiochirurgicznych).
W wypadku dłuższych zabiegów wskazane jest również założenie cewnika do pęcherza moczowego celem oceny diurezy, a w wypadku zabiegów brzusznych (szczególnie niedrożności) oraz pacjentów „z pełnym żołądkiem” zakłada się również zgłębnik do żołądka.
Pacjent kwalifikowany do planowego zabiegu operacyjnego musi być na czczo (oznacza to co najmniej dwugodzinny odstęp od ostatniego pojenia oraz 4-6 godzin od czasu ostatniego karmienia enteralnego, przy czym mleko z piersi matki uznaje się za pojenie, zaś mieszanki mleczne jako karmienie). Jeśli odstępy te nie są zachowane planowy zabieg powinno się (o ile to możliwe) odroczyć.
Premedykacja wcześniaka jest rekomendowana, ale nie we wszystkich ośrodkach stosuje się ją rutynowo. Obejmuje nie tylko leki sedatywne, ale również (choć nie wszędzie) przedoperacyjną atropinizację. Kiedyś powszechne było stosowanie benzodwuazepin w premedykacji w tej grupie noworodków, jednakże ze względu na częste występowanie epizodów drgawkowych u wcześniaków obecnie nie jest to polecane38.
1.4.3. Wyposażenie sali operacyjnej
Sala operacyjna powinna posiadać stanowisko chirurgiczne zapewniające nie tylko odpowiedni dostęp do pacjenta, ale również możliwość zabezpieczenia go przed wychłodzeniem (np. z promiennikiem cieplnym, materacykiem grzewczym itp.). Stanowisko anestezjologiczne oprócz aparatu do znieczulenia i centralnego dostępu gazów musi posiadać: worek samorozprężalny z rezerwuarem, laryngoskopy o różnych rozmiarach łyżek, rurki intubacyjne o właściwych rozmiarach, zestaw masek twarzowych, strzykawki automatyczne i pompy infuzyjne (w tym pompy do przetaczania krwi i produktów krwiopochodnych), zestawy do ogrzewania płynów itp.
1.4.3.1. Aparatura anestezjologiczna
Chyba największym problemem związanym ze znieczulaniem noworodków – wcześniaków – jest brak odpowiedniej aparatury anestezjologicznej spełniającej wymogi odnośnie wentylacji pacjenta o niskiej masie ciała, a w szczególności mniejszej niż 1000 gramów. Należy zauważyć, że chyba żaden aparat do znieczulenia na
świecie nie spełnia oczekiwań odnośnie wentylacji pacjenta z bardzo małą masą ciała. Należy przez to rozumieć zarówno możliwość ustawienia parametrów wentylacji adekwatnych do niewielkich rozmiarów struktur dróg oddechowych i płuc noworodka (często dotkniętych zmianami patologicznymi wymagających szczególnie precyzyjnych nastawów respiratora), ale również możliwości monitorowania skuteczności tej wentylacji (kapnografia, monitorowanie mechaniki oddychania, itp.). Do tego należy dołączyć możliwość podawania w mieszaninie oddechowej anestetyków wziewnych, co wiąże się z wyposażeniem takiego aparatu w stosowny parownik oraz monitor gazów. Do niedawna w większości ośrodków najczęściej używane były aparaty do znieczulenia, które w ogóle nie były przeznaczone do stosowania ich u tak małych pacjentów. Najczęściej lekarz anestezjolog stawał przed koniecznością adaptacji standardowego aparatu do znieczulenia dorosłych do warunków anestezji noworodka, np. wentylacja za pomocą układu Kuhna-Reese’a (np. zabiegi ligacji PDA), gdzie jedynym elementem regulującym był palec anestezjologa, co nie zapewniało dokładnej kontroli ciśnień i objętości w drogach oddechowych i powodowało związane z tym zwiększone ryzyko „barotraumy” (w tym „mikrobarotraumy” na poziomie pęcherzyków płucnych). Inną alternatywą było stosowanie do wentylacji respiratora noworodkowego (różne typy, włącznie z respiratorami umożliwiającymi wentylację typu High Frequency Ventilation oraz wentylację oscylacyjną), które co prawda zapewniają odpowiednie parametry oddechowe, ale podobnie jak układ Kuhna-Reese’a nie pozwalają na zastosowanie wziewnych środków anestetycznych. W konsekwencji, jedyną możliwością anestezji w takiej sytuacji była TIVA (znieczulenie ogólne całkowicie dożylne), co przy ograniczonym wyborze leków i wielu ich działaniach niepożądanych nie jest rozwiązaniem satysfakcjonującym, szczególnie dlatego, że często wiąże się ze zwiększonym zużyciem opioidów co, jak powszechnie wiadomo, przy długim czasie półtrwania tych leków nie pozostaje bez wpływu na parametry krążenia i oddychania.
relatywną rzadkość wykonywania procedur chirurgicznych u skrajnie niedojrzałych noworodków nie dziwi fakt, że technologie używane w aparatach do znieczulenia najmniejszego noworodka zostały nieco „z tyłu” w stosunku do innych produktów medycznych w anestezjologii i intensywnej terapii – stosowanych u szerszych i liczniejszych grup chorych.
Dopiero niedawno producenci aparatury anestezjologicznej wprowadzili na rynek aparaty do znieczulenia, które - najczęściej w trybie ciśnieniowym (PCV) - pozwalają na uzyskanie objętości odpowiednich dla dziecka o masie nawet 500 gramów, i dopasowanie ciśnień do rozmiarów i podatności płuc niewielkiego pacjenta, nawet takiego, który wymaga bardzo wysokich parametrów oddechowych. Można taki aparat wyposażyć w parowniki do stosowania halogenowych anestetyków wziewnych z monitorem gazów co umożliwia przeprowadzenie wziewnej indukcji znieczulenia. Złożone znieczulenie z komponentą wziewną wydaje się być korzystniejsze dla noworodka, jednak problem stanowi właściwe dopasowanie stężeń par anestetyku wziewnego w mieszaninie (dane literaturowe odnośnie MAC dla tych środków w populacji wcześniaków ze skrajnie niską masą ciała nie są kompletne w odniesieniu do wszystkich anestetyków wziewnych). Dla przykładu MAC (minimalne stężenie pęcherzykowe) dla izofluranu u wcześniaka w 28-32 tygodniu wieku postkoncepcyjnego jest około 1/3 mniejszy niż u noworodka donoszonego39. Pełne dane na temat MAC dla sewofluranu u noworodków urodzonych przedwcześnie nie są jeszcze szerzej dostępne40.
Należy podkreślić, iż w aparatach do znieczulenia stosowanych u bardzo małych wcześniaków każdy mililitr przestrzeni martwej (rur, filtrów, rurki intubacyjnej) ma ogromne znaczenie dla mechaniki oddychania. Dlatego też ważne jest odpowiednie ustawienie aparatu (możliwie blisko wentylowanego pacjenta, aby zastosować jak najkrótsze rury w obwodzie oddechowym), zrezygnowanie z filtrów i łączników o dużej przestrzeni martwej oraz – w miarę możliwości - skracanie rurek intubacyjnych.
U noworodka rurki intubacyjne stosowane są bez mankietu uszczelniającego. Powoduje to pewną nieszczelność i razem z innymi nieszczelnościami w układzie oddechowym sprawia, iż zapis kapnograficzny może być nieadekwatny (tj. zaniżone będą wartości etCO2). Z tych samych względów należy pamiętać o kompensacji
1.4.4. Monitorowanie śródoperacyjne
Konieczne w trakcie znieczulenia jest monitorowanie wszystkich podstawowych parametrów życiowych noworodka takich jak: saturacja, czynność serca, ciśnienie tętnicze, EKG, a także ciepłota ciała (najczęściej czujnik umieszczany na powierzchni skóry, z metalizowaną powierzchnią jeśli używany jest pod promiennikiem ciepła, ale również czujnik przełykowy lub doodbytniczy) oraz pomiar diurezy. W razie konieczności stosowany jest również: krwawy pomiar ciśnienia, pomiar ośrodkowego ciśnienia żylnego.
Niezbędne jest także monitorowanie gazów oddechowych oraz parametrów skutecznej wentylacji, tym bardziej wtedy, kiedy do znieczulenia używane są anestetyki wziewne.
Nie jest powszechne rutynowe
monitorowanie BIS (indeksu
bispektralnego) oraz AEP (słuchowych potencjałów wywołanych) u noworodków z niską masą ciała. Możliwe, iż jednym z powodów jest brak małych elektrod BIS dopasowanych do rozmiaru ciała wcześniaka. Poziom głębokości znieczulenia oceniamy pośrednio na podstawie standardowego monitorowania, tym niemniej należy zdawać sobie sprawę
z niedoskonałości tej metody, szczególnie wziąwszy po uwagę niedojrzałość mechanizmów regulacyjnych u noworodka. W chwili obecnej prowadzone są badania nad przydatnością analizy HRV (zmienności rytmu serca) do oceny reakcji stresowej w okresie okołooperacyjnym.
1.4.5. Opieka pooperacyjna
Ze względu na duże obciążenie organizmu wcześniaka związane zarówno z samym zabiegiem operacyjnym, znieczuleniem oraz bólem i jego niekorzystnymi następstwami, noworodek taki bezwzględnie wymaga intensywnego nadzoru pooperacyjnego, najczęściej w oddziale intensywnej terapii noworodka.
Opieka pooperacyjna:
- bezwzględnie: monitorowane stanowisko poooperacyjne (NICU),
- pulsoksymetr, monitor EKG, regularny pomiar ciśnienia tętniczego, i temperatury (powierzchownej i niekiedy głębokiej),
- monitorowanie reakcji bólowej
(u noworodka pod wpływem anestetyków – często niewidoczna reakcja neurobehawioralna). Badania laboratoryjne:
- do czasu uzyskania pełnej stabilizacji oddechowej - gazometria
- morfologia, glikemia i elektrolity.
Tabela 4. Warunki opieki pooperacyjnej w
Najczęściej nie ekstubuje się noworodka bezpośrednio po zabiegu operacyjnym w znieczuleniu ogólnym, ale wyczekuje do czasu ustąpienia działania leków anestetycznych. U pacjentów dotkniętych niewydolnością oddechową w bezpośrednim okresie przedoperacyjnym oraz pacjentów z dysplazją oskrzelowo – płucną, wsparcie oddechu za pomocą respiratora lub NCPAP (CPAP donosowy) może być dodatkowo wydłużone w czasie.
Dużym problemem, szczególnie po zabiegach brzusznych, są znaczne straty ciepła, toteż monitorowanie ciepłoty ciała noworodka jest kluczową sprawą. Umieszczenie dziecka w inkubatorze oraz osłona miejsc ciała szczególnie narażonych na utratę ciepła (głowa) nie zawsze są wystarczające. Niestety zbyt rzadko zwraca się uwagę na podawanie ogrzanych płynów i krwi (lub nie ma wystarczających możliwości jego zapewnienia), a prowadzić to może do niekiedy nawet znacznej hipotermii.
1.4.6. Znieczulenie do zabiegu laserowej fotokoagulacji siatkówki. 1.4.6.1. Przebieg zabiegu
W znieczuleniu ogólnym lub miejscowym, lekarz okulista zakłada rozwórkę pomiędzy obie powieki, a następnie, rotując gałkę oczną za pomocą wgłabiacza, wykonuje punktową, laserową koagulację nieunaczynionych obszarów siatkówki. Podczas zabiegu nawilża rogówkę za pomocą np. płynu Ringera, oraz – w razie potrzeby – dokrapla do worka spojówkowego środki rozszerzające źrenice.
Zabieg, w zależności od doświadczenia operatora i zaawansowania zmian chorobowych – trwa z reguły od 15 do 90 minut.
Po zabiegu oczy noworodka zabezpieczane są jałowym opatrunkiem. W pielęgnacji pooperacyjnej stosowane są maści ze sterydami, np. Atecortin.
1.4.6.2. Postępowanie anestezjologiczne
W przygotowaniu przedoperacyjnym, a także u niektórych pacjentów w trakcie zabiegu, stosuje się zakraplanie oczu za pomocą fenylefryny i tropicamidu. Wchłanianie tych środków z worka spojówkowego nie jest dokładnie określone w tej grupie pacjentów, jednak często obserwujemy efekty ich systemowego działania (tachykardia, wzrost ciśnienia tętniczego) świadczące o istotnym wchłanianiu do krążenia. Objawy te niekiedy utrudniają anestezjologowi właściwą ocenę bólu.
Zabieg laseroterapii jest bolesny i niestety wiele doniesień na ten temat potwierdza fakt, iż znieczulenie miejscowe nie jest wystarczające dla wykonania tej
procedury41-43. W wielu ośrodkach stosuje się znieczulenie ogólne (z intubacją lub bez intubacji dotchawiczej). Niestety, nie istnieje standard znieczulenia do tego zabiegu – obecne w literaturze wyniki badań obejmują zbyt małe grupy pacjentów aby można było wytyczyć właściwy sposób postępowania anestezjologicznego. W niniejszej rozprawie doktorskiej podjęto próbę analizy dotychczas stosowanych przez zespół anestezjologiczny GPSK-3 sposobów znieczulenia do tej procedury zabiegowej oraz oceny tych metod pod kątem jakości analgezji i ilości powikłań w okresie okołooperacyjnym.
1.4.7. Farmakologia niektórych leków znieczulenia ogólnego u noworodków i dzieci
W anestezjologii dziecięcej zasadniczo do dyspozycji jest wiele leków, którymi można skutecznie i bezpiecznie uzyskać odpowiednio głębokie znieczulenie ogólne, leków stosowanych od lat i dość gruntownie dzięki temu przebadanych. Tym niemniej, wzrost przeżywalności wśród skrajnie niedojrzałych noworodków sprawił, że na stole operacyjnym pojawił się nowy rodzaj pacjenta – który jednak nieco różni się od przeciętnego chorego pediatrycznego i obciążony jest jednocześnie wieloma istotnymi schorzeniami, wymagając przez to zupełnie innego podejścia. W tym kontekście farmakologia leków stosowanych w anestezji wcześniaka jest zagadnieniem dość nowym i niestety nie do końca opracowanym naukowo. Brak jest bowiem badań na dostatecznie dużych grupach pacjentów, szczególnie że przeprowadzanie takich badań jest dość trudne ze względów etycznych i technicznych. Sprawia to, iż wiele leków u wcześniaków stosowana jest „off label” i nie do końca możemy być pewni tego, że są równie bezpieczne jak u pacjentów pediatrycznych.
Najczęściej stosowanymi dożylnymi anestetykami u noworodków są ketamina, benzodwuazepiny (głownie midazolam) oraz thiopental, który jednak powodować może dość istotną depresję krążenia. Propofol (według zaleceń producentów, z uwagi na brak przeprowadzonych badań klinicznych) nie powinien być stosowany poniżej 1 miesiąca życia. Ketamina natomiast (2,5 – 3 mg/kg), mimo iż dość szeroko stosowana w anestezji dziecięcej, u wcześniaków powinna być stosowana bardzo ostrożnie – może bowiem zwiększać ryzyko bezdechów44. Poza tym, stosowanie ketaminy rodzi coraz więcej obaw związanych z jej potencjalnie szkodliwym wpływem na rozwijający się ośrodkowy układ nerwowy. Zagadnienie to zostanie omówione w dalszej części
1.4.7.1. Midazolam w znieczuleniu i sedacji noworodków i dzieci
Należy do krótko działających leków z grupy benzodiazepin. Działa nasennie i uspokajająco, ma dość szybki początek działania, związany z wpływem na receptory GABA, receptory benzodiazepinowe i kanały chlorkowe.
Metabolizowany jest głównie w wątrobie i częściowo wydalany przez nerki, czas półtrwania jest zróżnicowany: 4 do 6 godzin u noworodków donoszonych, zaś u noworodków przedwcześnie urodzonych może być niekiedy nawet znacznie wydłużony (około 12 godzin)45,46.
Może powodować depresję oddechową i bezdechy, obniża także ciśnienie tętnicze krwi (i w efekcie także rzut serca i przepływ mózgowy), czynność serca i napięcie mięśniowe. Mogą również wystąpić stany spastyczne układu oddechowego.
Midazolam w dawce 0,1-0,2 mg/kg jeszcze do niedawna był dość powszechny w sedacji oraz indukcji znieczulenia, ale w świetle ostatnich doniesień o tym, iż może obniżać próg drgawkowy u wcześniaków38 oraz że stosowanie midazolamu, zarówno samego i w połączeniach z innymi anestetykami (np. ketaminą) nasila zjawisko neuroapoptozy w rozwijającym się ośrodkowym układzie nerwowym dziś jest stosowany coraz rzadziej.
1.4.7.2. Opioidy
Spośród opioidowych środków przeciwbólowych najczęściej stosowane są fentanyl, sufentanyl, alfentanyl i niekiedy – remifentanyl.
Wspólną cechą tych leków jest wpływ na układ krążenia (zależne od dawki obniżenie ciśnienia tętniczego i zwolnienie czynności serca) oraz depresyjny wpływ na ośrodek oddechowy. Innym istotnym działaniem jest utrudniająca prawidłową wentylację sztywność klatki piersiowej.
Fentanyl. Jest silnie działającym opioidowym lekiem przeciwbólowym,
agonistą receptorów µ w ośrodkowym układzie nerwowym. Jest dobrze rozpuszczalny w tłuszczach i łatwo przenika przez barierę krew – mózg.
Metabolizowany jest w wątrobie i wydalany z moczem i z żółcią. Działa depresyjnie na ośrodek oddechowy, inne działania niepożądane to bradykardia, hipotensja, zaburzenia rytmu serca, sztywność mięśni klatki piersiowej (co niekiedy istotnie utrudnia wentylację), wzrost ciśnienia w drogach żółciowych, osłabienie perystaltyki jelit, skurcz krtani, uwalnianie histaminy i reakcje anafilaktoidalne. Fentanyl podawany we wlewie ciągłym może się kumulować w organizmie.
Remifentanyl w anestezji noworodka stosowany jest coraz szerzej, głównie ze
względu na bardzo krótki czas działania i szybką eliminację, niezależną od układu enzymów wątrobowych, bowiem rozkładany jest on przez niespecyficzne esterazy osoczowe. Farmakokinetyka remifentanylu u noworodka jest podobna do farmakokinetyki u dorosłego (przy czym dane te odnoszą się głównie do noworodków donoszonych)48, a większa objętość dystrybucji oraz szybka eliminacja przez esterazy osoczowe powoduje, iż czas półtrwania tego opioidu zazwyczaj mieści się w granicach 3-6, niekiedy do 10 min48. Powoduje on jednak sztywność klatki piersiowej oraz niekorzystne efekty hemodynamiczne zależne od dawki - bradykardię i hipotensję49-51, a co za tym idzie zmniejszony rzut serca.
1.4.7.3. Gazy anestetyczne i pary halogenowych środków wziewnych
Przy dostępności odpowiedniego aparatu do znieczulenia, anestezja z użyciem anestetycznych środków wziewnych pozwala na znaczne obniżenie stosowanych dawek opioidów. Ze względu na własności kardiodepresyjne, praktycznie nie stosuje się już halotanu i podtlenku azotu w znieczuleniu noworodków z niską masą ciała. Jednakże właściwie wszystkie z pozostałych anestetyków wziewnych (sewofluran, desfluran, izofluran) mają również depresyjny wpływ na układ sercowo naczyniowy52,53 objawiający się przede wszystkim obniżeniem ciśnienia tętniczego i przepływów mózgowych. Problemem jest brak danych na temat MAC (tj. minimalnego stężenia pęcherzykowego) dla tych anestetyków u noworodków przedwcześnie urodzonych, takie dane są szerzej dostępne głównie w odniesieniu do izofluranu (MAC w 100% tlenie dla noworodka donoszonego to ok. 1,6 Vol%, dla noworodka między 32 a 37 t.c. około 1,41 Vol%, zaś poniżej 32 t.c. około 1,28 Vol%)39.
1.4.8. Działanie środków znieczulenia ogólnego na ośrodkowy układ nerwowy noworodka
W ostatnich latach coraz większą obawę budzi możliwość szkodliwego wpływu środków anestetycznych na rozwijający się mózg, tym bardziej, że wpływ ten może być zauważalny dopiero po wielu miesiącach i latach (zagadnienie to jest szerzej omówione w rozdziale pt. „Dyskusja”).
Nie posiadamy wystarczającej wiedzy by z całą pewnością stwierdzić, że nasze postępowanie w okresie okołooperacyjnym jest w pełni bezpieczne i nie przyniesie negatywnych konsekwencji w postaci zaburzeń poznawczych, zaburzeń percepcji,
charakterologicznych i innych, które ujawnią się dopiero w późnym dzieciństwie lub nawet dorosłości.
Niestety, póki co brak jest alternatyw pozwalających na całkowite porzucenie dotychczasowych technik anestezji i jednoczesne zapewnienie bezpiecznego zabiegu operacyjnego bez bólu.
1.5. Analiza zmienności rytmu serca (Heart Rate Variability)
Czynność serca mierzona jest jako liczba uderzeń serca na minutę. Wartość tego parametru jest wynikiem ciągłej równowagi między układem współczulnym a przywspółczulnym, i oscyluje wokół pewnej określonej, średniej liczby. Fluktuacje te określa się mianem zmienności rytmu serca – HRV (Heart Rate Variability). Można je obliczyć na podstawie zapisu elektrokardiograficznego opierając się na odstępach między załamkami R. Wykorzystuje się tutaj dwa sposoby analizy: domena czasowa oraz częstotliwościowa (umożliwia identyfikację poszczególnych częstotliwości składowych mocy widma zmienności rytmu serca - spektrum mocy). Pierwsza z nich umożliwia, na podstawie wyliczeń statystycznych, określenie fluktuacji w krótkim okresie czasu (STV – short term variability – odchylenie standardowe odstępów RR następujących po sobie uderzeń serca w przeciągu 1 minuty) oraz dłuższym okresie czasu (LTV – long term variability – odchylenie standardowe odstępów RR wszystkich uderzeń serca w przeciągu jednej minuty). Analiza spektralna natomiast oprócz zmienności rytmu serca umożliwia również uzyskanie informacji o liczbie fluktuacji rytmu serca w przeciągu sekundy (częstość oscylacji). Obliczenia te są oparte na złożonym algorytmie matematycznym zwanym transformacją Fouriera 54-56.
Co ważne z punktu widzenia klinicznego, wartość HRV zmienia się w zależności od wpływu procesów fizjologicznych: oddychania, odruchu z baroreceptorów i termoregulacji. Jest również – w wypadku noworodków – odzwierciedleniem dojrzałości ośrodkowego układu nerwowego: HRV dodatnio koreluje z wiekiem postkoncepcyjnym (u wcześniaków HRV jest niższe niż u noworodków donoszonych nawet wtedy, kiedy osiągną już prawidłowy wiek postkoncepcyjny). Uszkodzenia dotyczące ośrodkowego układu nerwowego (niedotlenienie, krwawienia dokomorowe, leukomalacja okołokomorowa) również mają swoje odzwierciedlenie w zmianach rytmu serca: niższe HRV (zarówno STV jak
Odnaleziono także pewne zależności między innymi patologiami a HRV: u dzieci z rozpoznanym przetrwałym przewodem tętniczym Botalla HR było wyższe, jak i STV, natomiast LTV – niższe. HR i HRV nie zmieniały się po zamknięciu przewodu, zaś LTV rosło54,58.
Innym czynnikiem mogącym wpływać na wartość HRV jest też hipotrofia, zaś w chwili obecnej prowadzi się wiele badań nad wpływem różnych leków oraz pobudzania bądź tłumienia aktywności współczulnej.
Reasumując, trzeba zauważyć że noworodek urodzony jako wcześniak ze skrajnie niską masą ciała jest pacjentem dalece odmiennym fizjologicznie i pod względem wielkości od chorych dorosłych a nawet innych chorych pediatrycznych. Jest to pacjent z wieloma obciążeniami zdrowotnymi, wielokrotnie będącymi wskazaniami do wykonania procedur chirurgicznych. Nie należy zapominać, że ów niedojrzały pacjent może odczuwać ból i celem postępowania anestezjologa jest zniesienie tego niekorzystnego zjawiska i jego następstw w taki sposób, który będzie optymalny i bezpieczny dla młodego, rozwijającego się organizmu.
Wymaga to nie tylko szerokiej wiedzy i umiejętności, ale również dostępu do technologii dostosowanej do potrzeb małego człowieka.
Opierając się na obiektywnych, monitorowanych i statystycznie zanalizowanych parametrach opisujących stan pacjenta w niniejszej rozprawie doktorskiej podjęto próbę oceny, czy dotychczasowo stosowane techniki znieczulenia do zabiegu laseroterapii w świetle dzisiejszej wiedzy i możliwości były optymalne, oraz w jaki sposób można je zmodyfikować aby zapewnić jeszcze większy komfort i bezpieczeństwo chorego.
2. ZAŁOśENIA I CEL PRACY
Celem pracy jest porównanie różnych sposobów postępowania anestezjologicznego u noworodków przedwcześnie urodzonych, poddanych planowemu zabiegowi laserowej fotokoagulacji siatkówki, i wyodrębnić te, które wydają się być powiązane z szybszym powrotem wydolności oddechowej przy jednoczesnym braku objawów depresji krążenia.
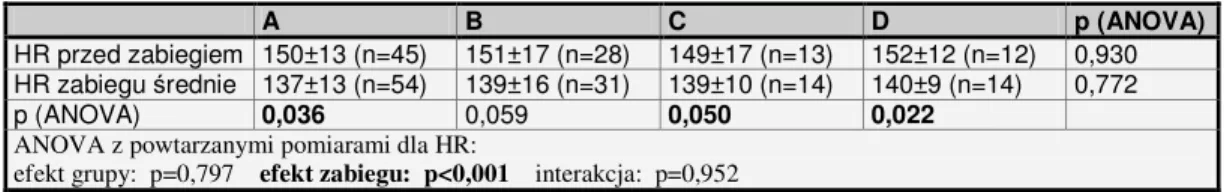
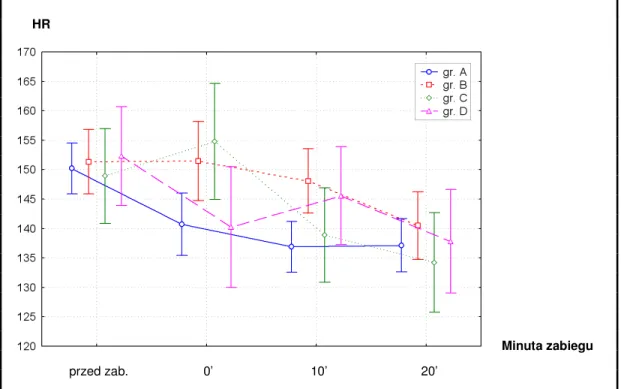
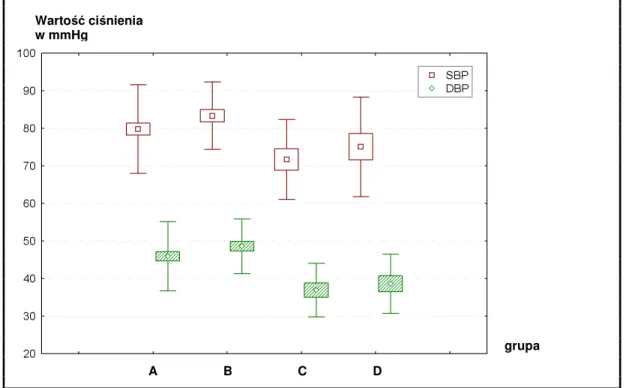
1. W oparciu o zawarte piśmiennictwo założono, iż reakcje metaboliczne i somatyczne noworodka w postaci zmian w częstości tętna, wartościach ciśnienia tętniczego, saturacji krwi włośniczkowej i poziomu glukozy we krwi są obiektywnymi wskaźnikami reakcji bólowej oraz że częstość ich występowania zależy od zastosowanego sposobu znieczulenia.
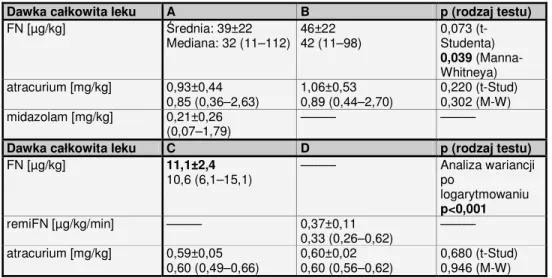
2. Stosowany do 2007 roku w Klinice Anestezjologii w Położnictwie i Ginekologii UM w Poznaniu sposób znieczulenia noworodka do zabiegu laserowej fotokoagulacji siatkówki oparty na podaży fentanylu w dawkach (10 – 100 µg/kg) w połączeniu z atracurium w dawce ok. 1 mg/kg i z midazolamem lub bez (0,2 mg/kg) powoduje konieczność wielogodzinnej sztucznej wentylacji.
3. Zastosowanie sewofluranu w znieczuleniu ogólnym do zabiegu laserowej fotokoagulacji siatkówki pozwoli na zmniejszenie odpowiedzi stresowej organizmu i zapewnienie szybszego niż w wypadku analgezji analeptycznej z zastosowaniem fentanylu odzyskiwania przez pacjenta wydolności oddechowej po operacji.
4. Zastosowanie sewofluranu pozwoli na zmniejszenie zastosowanej w znieczuleniu ogólnym dawki opioidu (tutaj: fentanylu).
5. Zastosowanie remifentanylu we wlewie ciągłym w dawce 0,3 – 0,5 µg/kg/min pozwoli na skrócenie czasu do powrotu wydolności oddechowej, nie powodując znaczniejszej niż podczas analgezji analeptycznej z fentanylem depresji układu krążenia wyrażonej spadkiem ciśnienia tętniczego i częstości tętna.
3. MATERIAŁ I METODY
3.1. Dobór chorych
Badania zostały przeprowadzone po uzyskaniu zgody Komisji Bioetycznej przy Uniwersytecie Medycznym im. Karola Marcinkowskiego w Poznaniu.
Badaniem objęto łącznie 113 noworodków przedwcześnie urodzonych (58 płci żeńskiej i 55 płci męskiej), poddanych planowemu zabiegowi laserowej fotokoagulacji siatkówki w Ginekologiczno – Położniczym Szpitalu Klinicznym w Poznaniu w latach 2004 - 2010.
Kryteria włączenia pacjentów do badania obejmowały:
- zabieg wykonywany z powodu retinopatii wcześniaczej, w trybie planowym, w znieczuleniu ogólnym,
- masę urodzeniową nie wyższą niż 1000 g,
a w bezpośrednim okresie przedoperacyjnym (minimum 24 godziny poprzedzające zabieg):
- prawidłowe parametry ciśnienia tętniczego i rytmu serca (nie podtrzymywane lekami presyjnymi ani antyarytmicznymi), prawidłowa saturacja,
- brak konieczności stosowania wentylacji mechanicznej (oddech własny, ewentualnie tlenoterapia bierna).
Kryteriami wykluczającymi z badania były: - masa urodzeniowa powyżej 1000 g,
- niewydolność oddechowa wymagająca stosowania wentylacji mechanicznej lub wsparcia oddechu metodą NCPAP,
- niewydolność krążenia wymagająca wlewu katecholamin bądź innych leków presyjnych,
- ciężkie zakażenie,
- podwyższona ciepłota ciała (>38°C)
- noworodki matki chorej na cukrzycę bądź noworodki z rozpoznanymi poważnymi zaburzeniami gospodarki węglowodanowej,
- noworodki transportowane do innego szpitala przed upływem 24 godzin od zakończenia zabiegu,
Zarówno dysplazja oskrzelowo płucna, jak i występowanie bezdechów przed operacją nie były kryteriami wykluczającymi z badania.
3.2. Przebieg projektu badawczego i grupy pacjentów
Badanie podzielono na dwie części: retrospektywną i prospektywną.
Część retrospektywna oparta była na analizie dokumentacji medycznej (kart zleceń
lekarskich, kart znieczulenia, kart obserwacji pielęgniarskich i wyników badań laboratoryjnych) noworodków znieczulanych do zabiegu laseroterapii siatkówki w Katedrze i Klinice Neonatologii Uniwersytetu Medycznego w Poznaniu w latach 2004-2007. Ze względu na retrospektywny charakter tej analizy, nie było możliwe dokładne metodologicznie zaplanowanie badania, równy podział na grupy, ani też odtworzenie wszystkich interesujących z punktu widzenia niniejszego projektu zdarzeń i wyników badań w okresie okołooperacyjnym. Jest to więc analiza oparta na mniejszej liczbie parametrów.
Część prospektywna została zaplanowana w oparciu o spostrzeżenia z części
retrospektywnej i objęła pacjentów operowanych w latach 2008-2010. Wszystkie noworodki włączone do prospektywnej części projektu badawczego znieczulane były przez tego samego anestezjologa i z wykorzystaniem identycznego sprzętu anestezjologicznego. Również leki i płyny przygotowywane były w jednakowy, standaryzowany sposób przez Aptekę Szpitalną GPSK.
Ze względu na dobro pacjentów, jak i możliwości techniczne, starano się wykonywać badania jak najmniej inwazyjne oraz ograniczyć do minimum ilość pobrań krwi, stąd też zrezygnowano z niektórych oznaczeń.
Pacjentów podzielono na cztery grupy: A i B – w części retrospektywnej
A. z użyciem fentanylu, midazolamu oraz atracurium (n=54); B. z użyciem wyłącznie fentanylu i atracurium (n=31).
C i D – w części prospektywnej (losowy przydział do grup): C. z użyciem sewofluranu, fentanylu i atracurium (n=14), D. z użyciem sewofluranu, remifentanylu i atracurium (n=14).
3.2.1 Część retrospektywna
W tej części badania zanalizowano dokumentację medyczną 85 noworodków (M:Ż = 42:43), w dwóch grupach:
• grupa A: Znieczulenie ogólne ze zwiotczeniem mięśni szkieletowych i intubacją dotchawiczą (indukcja dożylna midazolamem, fentanylem i atracurium), wentylacja mechaniczna z użyciem respiratora noworodkowego (parametry wentylacji dobrane tak, aby utrzymać saturację nie niższą niż 90%, optymalnie 93-98%); analgezja pooperacyjna: metamizol 40 mg/kg/dobę, w 4 dawkach podzielonych;
• grupa B: Znieczulenie ogólne ze zwiotczeniem mięśni szkieletowych i intubacją dotchawiczą (indukcja dożylna fentanylem i atracurium), wentylacja mechaniczna z użyciem respiratora noworodkowego (parametry wentylacji dobrane tak, aby utrzymać saturację nie niższą niż 90%, optymalnie 93-98% ); analgezja pooperacyjna: metamizol 40 mg/kg/dobę, w 4 dawkach podzielonych.
3.2.2. Część prospektywna
Część prospektywna objęła 28 pacjentów (grupy C i D) – lata 2008-2010
• grupa C: Znieczulenie ogólne z indukcją złożoną z użyciem sewofluranu (metodą wzrastających stężeń, od 2 do 5,5 Vol%), fentanylu w dawce 10 µg/kg masy ciała, ze zwiotczeniem mięśni szkieletowych (atracurium 0,6 mg/kg) i intubacją dotchawiczą, wentylacja mechaniczna za pomocą aparatu do znieczulenia Ohmeda Aespire 7900 (tryb PCV; parametry wentylacji dobrane tak, aby utrzymać saturację nie niższą niż 90%, optymalnie 93-98%); podtrzymanie znieczulenia sewofluranem – średnio 2-3,5 Vol%; analgezja pooperacyjna: paracetamol 60 mg/kg/dobę, w 4 dawkach podzielonych;
• grupa D: Znieczulenie ogólne z indukcją złożoną z użyciem sewofluranu (metodą wzrastających stężeń, od 2 do 5,5 Vol%), remifentanylu w dawce 0,75 µg/kg masy ciała, ze zwiotczeniem mięśni szkieletowych (atracurium, 0,6 mg/kg) ze zwiotczeniem mięśni szkieletowych i intubacją dotchawiczą, wentylacja mechaniczna za pomocą
aparatu do znieczulenia Ohmeda Aespire 7900 (tryb PCV; parametry wentylacji dobrane tak, aby utrzymać saturację nie niższą niż 90%, optymalnie 93-98%); podtrzymanie znieczulenia sewofluranem – średnio 2 - 3,5 Vol% oraz remifentanylem we wlewie ciągłym 0,3 – 0,5 µg/kg/min; analgezja pooperacyjna: paracetamol 60 mg/kg/dobę, w 4 dawkach.
3.2.3. Charakterystyka grup badanych noworodków
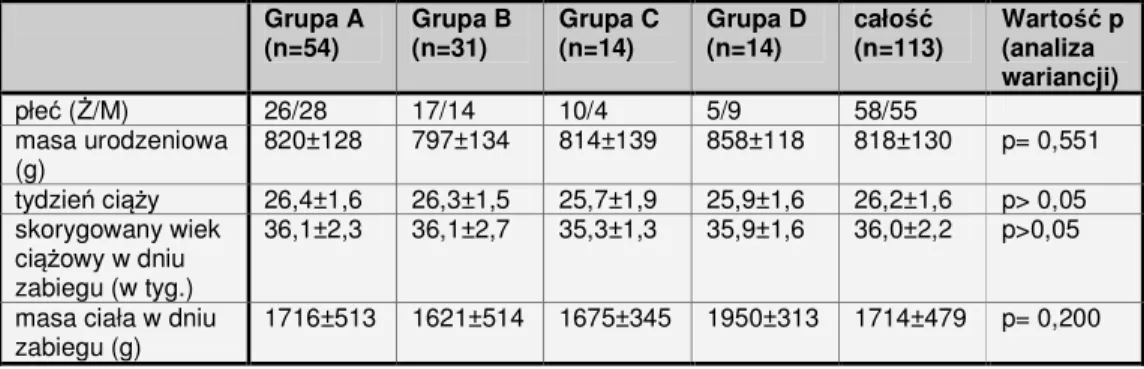
Spośród badanych noworodków w analizowanych grupach znalazło się 58 dziewczynek i 55 chłopców, urodzonych między 23 a 30 tygodniem ciąży. Kryterium zakwalifikowania do programu badawczego była masa ciała przy urodzeniu nie wyższa niż 1000 gramów, i wahała się ona między 520 a 1000 gramów (średnio 818±130 gramów). Zabieg operacyjny laserowej fotokoagulacji siatkówki wykonywany był w trybie planowym pomiędzy 36 a 107 dobą życia. W dniu zabiegu, dojrzałość określona na podstawie tzw. skorygowanego wieku ciążowego wahała się między 30 a 43 tygodniem (średnio 36,0±2,2), natomiast masa ciała w dniu operacji - między 930 a 3420 gramów (średnio 1714±479). Dane te nie różniły się statystycznie w poszczególnych grupach.
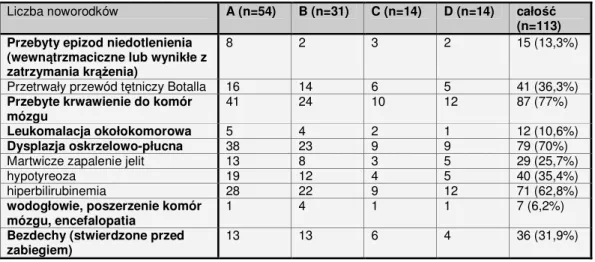
Szczegółowe dane dotyczące obciążeń zdrowotnych tych pacjentów, jak i przebiegu dotychczasowego leczenia zostały umieszczone w rozdziale „Wyniki”.
3.2.4. Przygotowanie i przebieg znieczulenia 3.2.4.1. Przygotowanie do zabiegu
U wszystkich noworodków przed zabiegiem rozszerzano źrenice za pomocą 0,5% tropicamidu (WZF Polfa) i 2,5% fenylefryny zakraplanych do worka spojówkowego nie wcześniej niż 2 godziny przed zabiegiem (co 15 minut po 1 kropli każdego z leków do
worka spojówkowego).
Około 10 godzin przed zabiegiem odstawiano karmienie doustne, zastępując je dożylną mieszanką do żywienia parenteralnego (zawierającą m.in. glukozę), według standardów stosowanycyh w Klinice Neonatologii. Przed zabiegiem nie stosowano
premedykacji farmakologicznej. Wszystkie noworodki posiadały założone wcześniej (w oddziale noworodkowym) – wkłucie dożylne (lub 2 wkłucia w przypadku tych pacjentów, którym podczas znieczulenia podawany był remifentanyl we wlewie ciągłym).
Po przyjeździe na salę operacyjną podłączano standardowe monitorowanie, na które składało się:
- pulsoksymetria (czujnik założony na stópce),
- stałe monitorowanie elektrokardiograficzne, trójodprowadzeniowe – II odprowadzenie - liczba uderzeń serca w ciągu minuty,
- pośredni pomiar ciśnienia tętniczego (mankiet dopasowany wielkością do rozmiaru ciała dziecka, na ramieniu),
- dodatkowo, w badaniach prospektywnych – kapnografia oraz przenośny aparat holterowski z możliwością analizy HRV (system Holtera firmy Mortara Instrument z oprogramowaniem H-Scribe), monitor gazów anestetycznych (zintegrowany z aparatem do znieczulenia Ohmeda Aespire 7900).
Zabieg przeprowadzany był za pomocą lasera diodowego OcuLight SL firmy IRIS Medical (rok prod. 2002).
3.2.4.2. Przebieg znieczulenia
Badania retrospektywne (grupy A i B). Indukcję znieczulenia uzyskiwano za pomocą dożylnej podaży fentanylu i atracurium, oraz - w przypadku grupy A - midazolamu. Po zwiotczeniu mięśni szkieletowych noworodka intubowano, a następnie podłączano do respiratora noworodkowego, w trybie IMV (Intermittent Mandatory Ventilation). Parametry wentylacji (PIP, PEEP, częstość oddechów, FiO2)
dopasowywano tak, aby uzyskać saturację nie niższą niż 90% (optymalnie 93-98%), prawidłowe szmery oddechowe i unoszenie się klatki piersiowej. Ze względu na to, iż nie dysponowano jeszcze wówczas w Klinice aparatem do znieczulenia z możliwością wentylacji w trybie ciśnieniowym, odpowiedniego dla najmniejszych
noworodków, nie stosowano środków wziewnych, a podtrzymanie anestezji odbywało się z użyciem frakcjonowanych dawek opioidu i ewentualnie leku zwiotczającego podawanych dożylnie. Nie monitorowano również etCO2 ani objętości oddechowych.
Płynoterapia w trakcie zabiegu operacyjnego polegała na dożylnej podaży żywienia parenteralnego, w dawce i przepływie jak przed zabiegiem.
Badania prospektywne (grupy C i D). Indukcję znieczulenia uzyskiwano metodą „złożoną” – wziewną i dożylną: po wypełnieniu układu anestetycznego mieszaniną tlenu, powietrza i sewofluranu, oraz biernym natlenieniu noworodka, pacjent oddychał spontanicznie przez maskę twarzową (indukcja wziewna metodą „wzrastających stężeń” – średnio od 2 Vol% sewofluranu w mieszaninie oddechowej, do 4 – 5,5 Vol% przy przepływie gazów 4 l/min, przez około 3 min, do zaśnięcia). Następnie podawano dożylnie fentanyl (WZF Polfa) w dawce 10 mcg/kg (grupa C) lub remifentanyl (preparat Ultiva Glaxo Smith Kline) 0,75 µg/kg (grupa D) oraz atracurium (preparat Tracrium firmy Roche) w dawce 0,6 mg/kg. Po uzyskaniu zwiotczenia mięśni noworodka intubowano oraz podłączano do aparatu do znieczulenia (Aparat Ohmeda Aespire 7900). Podobnie jak w grupach retrospektywnych, parametry wentylacji (tryb ciśnieniowy – PCV – Pressure Control Ventillation) dopasowywano tak, aby uzyskać saturację nie niższą niż 90% (optymalnie 93-98%), prawidłowe szmery oddechowe i unoszenie się klatki piersiowej.
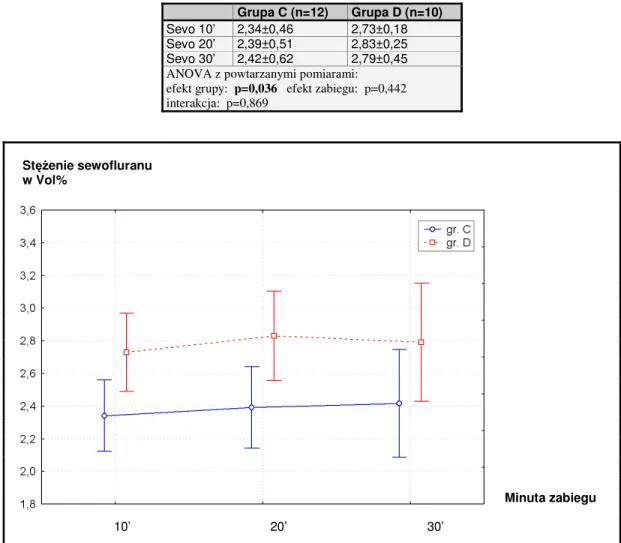
Podtrzymanie znieczulenia odbywało się dzięki podaży sewofluranu w mieszaninie z tlenem i powietrzem (ok. 2,5-3,5 Vol%, przepływ 2 l/min, pod kontrolą monitora gazów), oraz podaży frakcjonowanych dawek fentanylu (grupa C, w razie objawów niewystarczającej analgezji) lub ciągłego wlewu remifentanylu w dawce 0,3 – 0,5 µg/kg/min (grupa D). Jednocześnie ustalono z operatorem, że uprzedzi anestezjologa o zbliżającym się końcu zabiegu, aby ok. 3 - 5 min przed końcem procedury można było zatrzymać wlew remifentanylu i zamknąć dopływ sewofluranu.
Ryc. 5. Zapis z monitora aparatu do znieczulenia Ohmeda Aespire 7900 przedstawiający parametry wentylacji podczas zabiegu (wł. autorki).
Noworodki w grupie D przed zamknięciem wlewu remifentanylu otrzymywały również dożylny wlew paracetamolu (Perfalgan firmy Bristol – Myers Squibb) w dawce 15 mg/kg.
Płynem podawanym w trakcie procedury był roztwór mleczanu Ringera z 1% glukozą w dawce 3 ml/kg/godz.
Na karcie znieczulenia odnotowywano (z podaniem godziny i minuty) wszelkie zdarzenia które miały miejsce podczas zabiegu (np. dodatkowe zakraplanie oczu fenylefryną i tropicamidem), jak również parametry wentylacji, stężenie sewofluranu w mieszaninie oddechowej i inne istotne informacje.
3.2.5. Opieka pooperacyjna
Wszystkie noworodki w okresie pooperacyjnym były leczone i poddane nadzorowi w oddziale Intensywnej Terapii Noworodka Kliniki Neonatologii.
Standardowe monitorowanie pooperacyjne obejmowało: - pulsoksymetrię,
- pomiar ciśnienia tętniczego w regularnych odstępach czasu (co 3 godziny), - pomiar diurezy,
- stały pomiar czynności serca,
- badania gazometryczne krwi włośniczkowej (z oznaczeniem glikemii) w 1, 3, 6, 12 i 24 godzinie po zabiegu.
Dodatkowo, w prospektywnej części badań, w następnej dobie po zabiegu w godzinach porannych oznaczano również morfologię krwi obwodowej oraz poziom mocznika i kreatyniny w surowicy krwi.
W ramach analgezji pooperacyjnej noworodki z grup A i B otrzymywały dożylnie metamizol 10 mg/kg/dawkę (4 razy na dobę), zaś z grup C i D – paracetamol 15 mg/kg/dawkę (4 razy na dobę).
Pielęgnacja oczu w okresie pooperacyjnym polegała na stosowaniu maści Atecortin 6 razy na dobę oraz jałowych opatrunków.
Do czasu pełnego wybudzenia dziecka, odzyskania odruchów i wydolności oddechowej nie włączano ponownie karmienia enteralnego – podawano żywienie parenteralne wyliczone zgodnie z zapotrzebowaniem w danej dobie życia i na daną masę ciała (przy czym podaż węglowodanów była odnotowywana w dokumentacji medycznej).