Uniwersytet Medyczny im. Karola Marcinkowskiego w Poznaniu
Katedra i Zakład Farmakologii
Natalia Wachowiak
Badania aktywności przeciwbólowej i przeciwzapalnej
wybranych acylowanych pochodnych hydroksyiminowych kwasu
oleanolowego
Praca doktorska
Promotor: Prof. UM dr hab. n. farm. Przemysław Mikołajczak
Słowa kluczowe: kwas oleanolowy, triterpeny, aktywność przeciwbólowa, aktywność przeciwzapalna, TLR, cytokiny
Praca została wykonana we współpracy z:
Katedrą i Zakładem Chemii Organicznej Uniwersytetu Medycznego im. Karola Marcinkowskiego w Poznaniu – w zakresie syntezy i dostarczenia substancji stanowiących temat niniejszej rozprawy,
Katedrą i Zakładem Farmacji Fizycznej i Farmakokinetyki Uniwersytetu Medycznego im. Karola Marcinkowskiego w Poznaniu – w zakresie pomocy w obliczeniach parametru - AUC z uzyskanych wyników farmakodynamicznych,
Pracownią Farmakogenetyki Doświadczalnej Katedry i Zakładu Farmacji Klinicznej i Biofarmacji Uniwersytetu Medycznego im. Karola Marcinkowskiego w Poznaniu – w zakresie przygotowania i oznaczania prób w badaniach genetycznych.
Pragnę serdecznie podziękować promotorowi,
Panu prof. UM dr hab. Przemysławowi
Mikołajczakowi za umożliwienie wykonania pracy doktorskiej, nieocenioną pomoc przy jej realizacji, a przede wszystkim za serdeczność i wyrozumiałość, ogrom przekazanej wiedzy i motywację
Składam serdeczne podziękowania
Pani dr n. biol. Ewie Kamińskiej za pomoc w
doświadczeniach, gotowość do pracy, wyrozumiałość oraz cenne wskazówki podczas pracy badawczej
Panu Andrzejowi Kobzdzie za opiekę nad zwierzętami podczas wykonywanych doświadczeń
Pani dr n. farm. Annie Bogacz, Pani dr n. biol. Joannie Bartkowiak-Wieczorek oraz Panu dr n. farm.
Michałowi Szulcowi za pomoc w przygotowaniu i oznaczeniu prób do badań biochemicznych i genetycznych
Pracownikom Katedry i Zakładu Farmakologii
Uniwersytetu Medycznego im. Karola Marcinkowskiego w Poznaniu za miłą atmosferę podczas wykonywania pracy, wszelką pomoc i życzliwość
Niniejszą pracę dedykuję Najbliższym i Przyjaciołom
SPIS TREŚCI
WYKAZ SKRÓTÓW I NAZW CHEMICZNYCH………....……...8
1. Wstęp ... 12
2. Część Teoretyczna ... 14
2.1. PODŁOŻE PROCESU ZAPALNEGO ... 14
2.2. BÓL W PRZEBIEGU PROCESU ZAPALNEGO ... 18
2.3. WYBRANE MEDIATORY BÓLU I PROCESU ZAPALNEGO ... 20
2.3.1. Cytokiny ... 22
2.3.2. PAF ... 23
2.3.3. Elastaza... 24
2.3.4. Układ dopełniacza ... 24
2.3.5. Układ kalikreina – kininy ... 26
2.3.6. NF-κB ... 27
2.3.7. Receptory Toll-like ... 29
2.4. AKTYWNOŚĆ PRZECIWBÓLOWA I PRZECIWZAPALNA KWASU OLEANOLOWEGO I JEGO POCHODNYCH ... 33
3. Cel Pracy ... 41
4. Część Doświadczalna ... 42
4.1. MATERIAŁ ZWIERZĘCY I OGÓLNE WARUNKI DOŚWIADCZENIA ... 42
4.2. APARATURA I ODCZYNNIKI ... 43
4.2.1. Odczynniki i substancje stosowane w badaniach farmakodynamicznych ... 43
4.2.2. Przygotowanie roztworów do doświadczeń farmakodynamicznych ... 43
4.2.3. Odczynniki i substancje użyte w badaniach biochemicznych i genetycznych ... 44
4.2.4. Sprzęt i aparatura wykorzystana w przebiegu doświadczeń farmakodynamicznych ... 45
4.2.5. Sprzęt i aparatura wykorzystana w przebiegu badań biochemicznych i genetycznych ... 45
4.3. TESTY FARMAKODYNAMICZNE ... 46
4.3.1. Ocena toksyczności ostrej ... 46
4.3.2. Ocena spontanicznej aktywności ruchowej – „locomotor activity” ... 47
4.3.3. Ocena działania przeciwbólowego w teście „gorącej płyty”: test „hot – plate” ... 47
4.3.4. Ocena działania przeciwzapalnego w teście karageninowym za pomocą pletyzmometru ... 49
4.4. SCHEMATY DOŚWIADCZEŃ ... 52
4.4.1. Określenie toksyczności ostrej granicznej ... 52
4.4.2. Wyznaczenie ruchliwości horyzontalnej i wertykalnej oraz badanie i ocena działania przeciwbólowego za pomocą testu hot-plate ... 52
4.4.3. Ocena aktywności przeciwzapalnej badanych substancji w teście karageninowym za pomocą pletyzmometru ... 55
4.4.4. Badanie zjawiska tolerancji dla najbardziej aktywnej substancji w najbardziej efektywnej dawce w podawaniu 4 – tygodniowym ... 57
4.4.5. Postępowanie z materiałem pobranym do badań biochemicznych i genetycznych .58 4.5. ANALIZA STATYSTYCZNA ... 62
4.6. OBLICZENIA AUC ... 63
5. Wyniki ... 64
5.1. BADANIE TOKSYCZNOŚCI OSTREJ METODĄ USTALONEJ DAWKI ... 64
5.2. OCENA HORYZONTALNEJ ORAZ WERTYKALNEJ AKTYWNOŚCI LOKOMOTORYCZNEJ ... 65
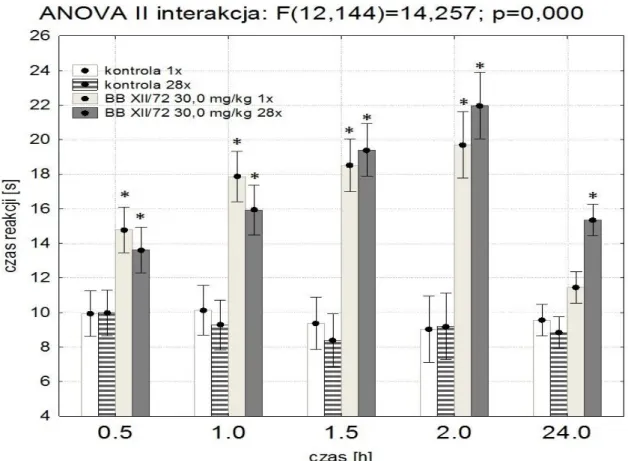
5.3. OCENA DZIAŁANIA ANTYNOCYCEPTYWNEGO W TEŚCIE „HOT-PLATE” ... 71
5.4. OCENA DZIAŁANIA PRZECIWZAPALNEGO ... 103
5.5 OKREŚLENIE WPŁYWU ZJAWISKA TOLERANCJI DLA NAJBARDZIEJ AKTYWNEJ SUBSTANCJI .... 121
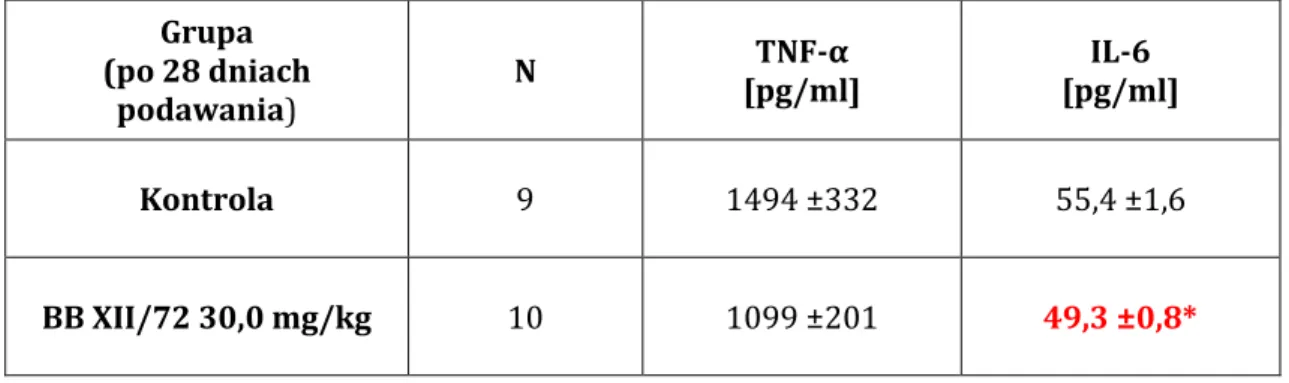
5.6 WPŁYW POCHODNEJ KWASU OLEANOLOWEGO NA STĘŻNIA WYBRANYCH INTERLEUKIN U SZCZURÓW ... 124
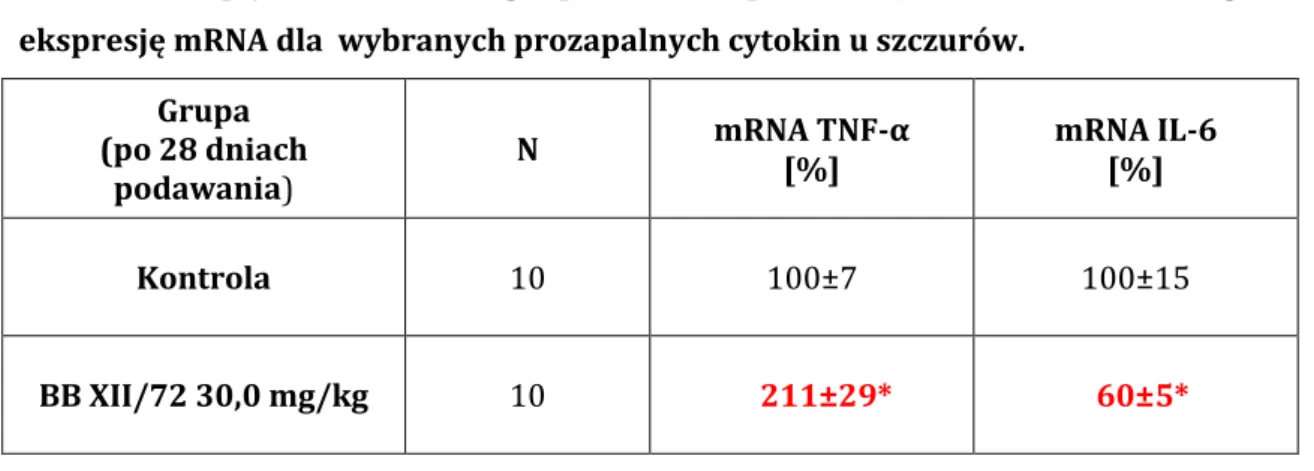
5.7. WPŁYW POCHODNEJ KWASU OLEANOLOWEGO NA EKSPRESJĘ mRNA WYBRANYCH INTERLEUKIN U SZCZURÓW ... 125
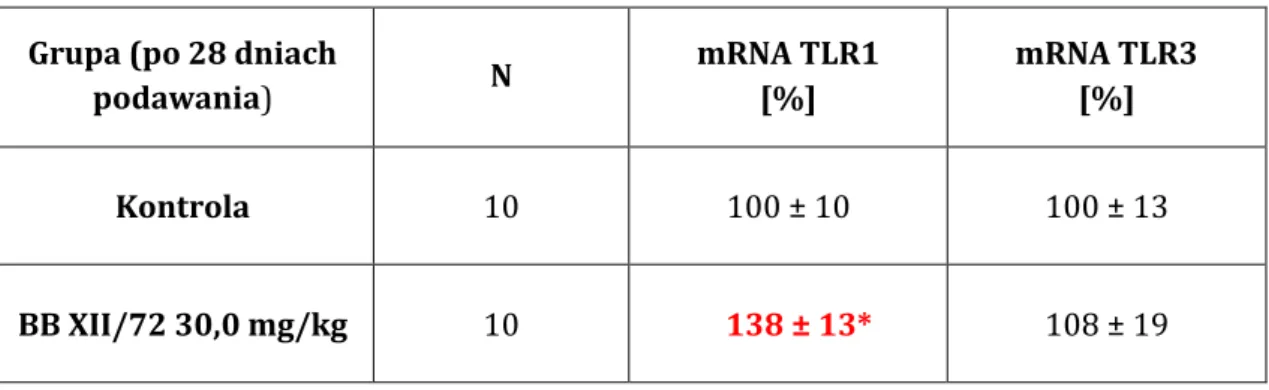
5.8. WPŁYW POCHODNEJ KWASU OLEANOLOWEGO NA EKSPRESJĘ mRNA TLR1 I TLR3 U SZCZURÓW... 126
6. Dyskusja i omówienie wyników... 127
7. Wnioski ... 137
7. Streszczenie ... 138
8. Abstract ... 140
9. Piśmiennictwo ... 142
W
YKAZS
KRÓTÓW IN
AZWC
HEMICZNYCH8
WYKAZ SKRÓTÓW I NAZW CHEMICZNYCH
5-HT serotonina (5-hydroksytryptamina)
Ach acetylocholina
ANOVA analiza wariancji
ASA kwas acetylosalicylowy
ATP adenozyno-5’-trifosforan
AUC pole powierzchni pod krzywą (z ang. Area Under the Curve)
βAS syntaza β-amarynowa
BB XII/59 ester metylowy kwasu 3-(2-acetoksy-1-benzoil)oksyiminoolean-12-en-28-owego
BB XII/72 morfolid kwasu 3-(2-acetoksy-1-benzoil)oksyiminoolean-12-en-28-owego
BB XII/73 kwas 3-(2-acetoksy-1-benzoil)oksyiminoolean-12-en-28-owy BDNF neurotropowy czynnik pochodzenia mózgowego (z ang.
Brain-Derived Neurothrophic Factor)
BK bradykinina
BK1, BK2 receptor dla bradykininy 1 lub 2
CAS syntaza cykloartenolu
CDDO kwas 2-cyjano-3,12-diokso-oleano-1,9(11)-dien-28-owy
CDDO-Me ester metylowy kwasu 2-cyjano-3,12-diokso-oleano-1,9(11)-dien-28-owego
cDNA komplementarny kwas deoksyrybonukleinowy
c-Flip białko FLIP komórkowe = (FADD-like IL-1β-converting enzyme – kaspaza 8)-inhibitory protein – białko hamujace Flip, gdzie FADD – z ang. Fas-Associated Protein with Death Domain- związane z Fas białko adaptorowe z domeną śmierci
CGRP białko związane z genem kalcytoniny (z ang. Calcitonin Gene-Related Peptide)
cm3 centymetr sześcienny
COX cyklooksygenaza
CpG DNA „wyspy” cytozynowo-guaninowe kwasu deoksyrybonukleinowego CRP białko C-reaktywne (z ang. C-Reactive Peptide)
W
YKAZS
KRÓTÓW IN
AZWC
HEMICZNYCH9
CSF czynnik stymulujący kolonie (z ang. Colony-Stimulating Factor) DEPC pirowęglan dietylu (z ang. Diethylopirocarbonate)DNA kwas deoksyrybonukleinowy
dsRNA dwuniciowy kwas rybonukleinowy (z ang. double stranded RNA) ECAM-1 śródbłonkowy czynnik adhezji komórek 1 (z ang. Endothelial Cell
Adhesive Molecule 1)
E. coli pałeczki okrężnicy (Escherichia coli T.)
EDF czynnik różnicujący eozynofile (z ang. Eosinophil Differentation Factor)
ELISA test immunoabsorpcyjny (z ang. Enzyme-Linked Immunosorbent Assay)
ERK kinaza regulowana zewnątrzkomórkowo (z ang. Extracellular signal-regulated Kinase)
Fas białko receptorowe błony komórkowej komórki należace do rodziny TNF także znane jako CD95, włączone w procesy apoptotyczne
g gram
G-CSF czynnik stymulujący tworzenie kolonii granulocytów (z ang. Granulocyte Colony-Stimulating Factor)
GM-CSF czynnik stymulujący tworzenie kolonii granulocytów i makrofagów (z ang. Granulocyte Macrophage Colony-Stimulating Factor)
GUS Główny Urząd Statystyczny
h godzina (z ang. hour)
HSP białko szoku cieplnego (z ang. Heat Shock Protein)
HTLV1 ludzki wirus T-limfotropowy (z ang. Human T-lymphotropic Virus 1)
i.p. podanie dootrzewnowe (z ang. intraperitoneal injection)
IASP Międzynarodowe Towarzystwo Badania Bólu (z ang. International Association for the Study of Pain)
ICAM-1 międzykomórkowa molekuła adhezyjna – 1 (z ang. Intracellular Adhesion Molecule 1)
IF interferon
IκB inhibitor κB
IKK kinaza inhibitora κB
IL interleukina
iNOS indukowana syntaza tlenku azotu
W
YKAZS
KRÓTÓW IN
AZWC
HEMICZNYCH10
LL ligustr lśniący (z łac. Ligustrum lucidum)LP ligustr japoński (z łac. Ligustrum japonicum var. pricei)
LPS lipopolisacharyd
LRR powtórzenia bogate w leucynę (z ang. Leucine Rich Repeats) LTA kwas lipotejchojowy (z ang. Lipoteichoic Acid)
LTB leukotrieny typu B
M mol
mM milimol
MAC kompleks atakujący błonę (z ang. Membrane Attacking Complex) MCP-1 białko chemotaktyczne dla monocytów-1 (z ang. Monocyte
Chemoactive Protein 1)
MF morfina
mg milligram
min minuta
ml mililitr
MMTV mysi wirus raka sutka (z ang. Mouse Mammary Tumor Virus) mRNA matrycowy kwas rybonukleinowy
MyD88 białko adaptorowe (z ang.
Myeloid Differentiation Primary
Response Protein 88)
NaCl chlorek sodu
NF-κB jądrowy czynniki transkrypcyjny κB (z ang. Nuclear Factor - κB) NK naturalni zabójcy (z ang. Natural Killers)
NL nalokson
NLPZ niesteroidowe leki przeciwzapalne OA kwas oleanolowy (z ang. Oleanolic Acid)
OECD Organizacja Współpracy Gospodarczej i Rozwoju
(z ang. The Organisation for Economic Co-orporation and Development)
OTC leki wydawane bez przepisu lekarza (z ang. Over-the-Counter)
OUN ośrodkowy układ nerwowy
p.o. podanie dożołądkowe (z łac. per os)
p50/p65 białko o masie cząsteczkowej 50 lub 65 kDa
PAF czynnik aktywujący płytki (z ang. Platelet-Activating Factor) PAF-AH acetylohydrolaza czynnika aktywującego płytki
W
YKAZS
KRÓTÓW IN
AZWC
HEMICZNYCH11
PAMPs wzorce molekularne związane z patogenami(z ang. Pathogen-Associated Molecular Patterns)
PARFs receptory dla PAF (z ang. Platelet-Activating Factor Receptors) PCR reakcja łańcuchowa polimerazy (z ang. Polimerase Chain Reaction) PGE2 prostaglandyna E2
PLA2 fosfolipaza A2 (z ang. Phospholipase A2)
RNA kwas rybonukleinowy
RNaza rybonukleaza
RSV wirus ludzki RNA odpowiedzialny za infekcje dróg oddechowych u dzieci i niemowląt (z ang. Respiratory Syncytial Virus)
rt-PCR reakcja łańcuchowa polimerazy w czasie rzeczywistym (z ang. Real Time Polimerase Chain Reaction)
RZS reumatoidalne zapalenie stawów
s sekunda
s.c. podanie podskórne (z łac. sub cutis; z ang. - subcutaneus injection)
SE epoksydaza skwalenu
SEM standardowy błąd pomiaru (z ang. Standard Error of Measurement)
SNP nitroprusydek sodu
sP substancja P
SS syntaza skwalenu
t0,5 czas połowicznego trwania
TCR receptory dla limfocytów T (z ang. T Cell Receptor)
TGF-β transformujący czynnik wzrostu β (z ang. Transforming Growth Factor β)
TIR domena wspólna dla receptora Toll-like oraz dla receptora IL-1 (Toll/IL-1R)
TLR receptor Toll-podobny (z ang. Toll-like Receptor)
TNF-α czynnik martwicy nowotworu α (z ang. Tumor Necrosis Factor α) TRIF domena TIR indukująca interferon β (IFNβ)
UV promieniowanie ultrafioletowe (z ang. Ultra Violet)
VCAM-1 molekuła adhezyjna-1 komórki naczyniowej(z ang. Vascular Cell Adhesion Molecule 1)
WSTĘP
12
1. Wstęp
W ostatnich latach obserwujemy dynamiczny rozwój wiedzy na temat mechanizmów powstawania bólu, ale również jego istoty i metod leczenia. W dzisiejszych czasach zniesienie bólu nie jest problemem samym w sobie, problemem są liczne działanie uboczne standardowo stosowanych w tym celu preparatów, jak również przechylająca się szala skuteczności leczenia przeciwbólowego i przeciwzapalnego na niekorzystną stronę interakcji i zaburzeń metabolicznych wywołanych leczeniem. Zasady farmakoterapii bólu każą likwidować go niezależnie od przyczyny, a leczenie powinno wyprzedzać moment pojawienia sie bólu i być w najdogodniejszej dla pacjenta formie, z możliwie najmniejszym wpływem negatywnym na organizm. W przypadkach bardziej skomplikowanych leczenie farmakologiczne powinno być uzupełnione przez fizyko- lub psychoterapię.
Według danych Głównego Urzędu Statystycznego (GUS) z 2013 roku, w Polsce sprzedano ponad 2 miliardy tabletek preparatów leczniczych wydawanych bez recepty lekarskiej, z grupy tzw. OTC (z ang. over-the-counter). Zdecydowana większa część sprzedawanych preparatów zawierała w swoim składzie komponentę o działaniu przeciwbólowym lub/i przeciwzapalnym, w przeróżnych dawkach, kombinacjach i wskazaniach do stosowania. Od wielu lat rynek farmaceutyczny obraca sie wokół leków o tej samej budowie chemicznej. Niesteroidowe leki przeciwzapalne (NLPZ) stanowią jedną z lepiej poznanych pod względem właściwości farmakologicznych grupą leków i najczęściej wybieraną pośród pacjentów.
Malejąca kontrola nad lekiem związana jest przede wszystkim ze wzgledu na rosnącą ilość preparatów z komponentą przeciwbólową i przeciwzapalną na rynku farmaceutycznym, zmiana klasyfikacji dostępności preparatów leczniczych dostępnych dotychczas jedynie z przepisu lekarza na kategorię OTC, wszechobecna reklama w mediach, dostępność tych preparatów na półkach sklepowych czy stacjach benzynowych, które sprzedawne są bez jakiegokolwiek nadzoru. Powyżej opisana sytuacja powinna rodzić obawy ze strony lekarzy i farmaceutów, ale przede wszystkim urzędników państwowych odpowiedzialnych za politykę zdrowotną. Niekontrolowane spożywanie środków przeciwbólowych wiąże się z narastającymi problemami zdrowotnymi
WSTĘP
13
pacjentów, występowaniem częstych działań niepożądanych, a w konsekwencji nowych dolegliwości i schorzeń, które niejednokrotnie wymagają hospitalizacji lub ja wydłużają.Naukowcy na całym świecie poświęcają wiele wysiłku, aby znaleźć nowe substancje aktywne, które byłyby wysoko wyspecjalizowane w zwalczaniu przyczyn powstawania bólu, jego hamowania, i które pozwoliłyby na najszybsze i najskuteczniejsze zniesienie stanu zapalnego. Ponadto, kolejnym kryterium miezwykle istotnym w każdej terapii jest wyodrębnienie cząsteczki o możliwie najwyższym współczynniku bezpieczeństwa stosowania, a zatem charakteryzującą się bardzo niską toksycznością podczas przewlekłego podawania. Ze wzgledu na dodatkowy czynnik, jakim jest występowanie współistniejących chorób przewlekłych, nowa czasteczka nie powinna dawać interakcji z innymi lekami, w przypadku stosowania politerapii.
Poszukiwania nowych, efektywnie działających, a jednocześnie bezpiecznych preparatów, skierowało badaczy w kierunku fitoterapii i promowania związków szeroko rozpowszechnionych w naturze. Dużym zainteresowaniem cieszą się pochodne kwasu oleanolowego, który ze względu na swoją budowę chemiczną należy do bardzo zróżnicowanej grupy pod względem struktury chemicznej, tzw. triterpenoidów. W badaniach eksperymentalnych in vitro i in vivo, wykazano wielokierunkowość aktywności pochodnych triterpenowych, a do tej pory najmocniej zostało zaznaczone działanie przeciwdrobnoustrojowe oraz metaboliczne, związane z przemianami lipidowo-węglowodanowymi, z których warto wyszczególnić aktywność przeciwmiażdżycową. Kolejne doniesienia wskazują na silne działanie hepatoprotekcyjne pochodnych, stosowanych w przebiegu uszkodzenia wątroby przez kancerogeny i czynniki hepatotoksyczne, ich działanie antyoksydacyjne, a także coraz częściej udowadniane działanie przeciwnowotworowe oraz działanie przeciwzapalne. Dotychczasowe prace dotyczące działania przeciwzapalnego pochodnych kwasu oleanolowego, skupiają się przede wszystkim wokół chorób o podłożu neurodegeneracyjnym (parkinsonizm, choroba Alzheimer’a, pląsawica Huntington’a), z współistniejącym bólem neuropatycznym, ale prowadzone są badania nad ich ewentualnym zastosowaniu w hamowaniu zapalenia.
Jednak pomimo wielu doniesień naukowych oraz szeroko stosowanych praparatów triterpenowych w medycynie ludowej, zwłaszcza na terenach Azji, jak do tej pory nie udało się jednoznacznie ustalić ich molekularnego mechanizmu działania przeciwzapalnego i/lub działania przeciwbólowego, co pozwoliło by na rozwój terapii celowanej i bardziej precyzyjne stosowanie tych środków u potrzebujących pacjentów.
CZĘŚĆ TEORETYCZNA
14
2. Część Teoretyczna
2.1.
P
ODŁOŻEP
ROCESUZ
APALNEGOKażdy organizm żywy dąży do osiągnięcia hemostazy. Ma to miejsce dzięki wykorzystaniu oraz funkcjonowaniu wielu wysoko wyspecjalizowanych układów, jak również zróżnicowanych mechanizmów obrony, które pozwalają zaadoptować go do otaczającego środowiska. Pozwalająone na szybką reakcję w razie narażeniana czynniki i bodźce stresowe dla organizmu, doprowadzając do neutralizacji czynnika szkodliwego. Zapalenie lub odczyn zapalny (z łac. inflammatio) jest reakcją obronną organizmu, która ma na celu usunięcie lub zniszczenie przyczyny uszkodzenia komórek, z często występującym przerwaniem integralności tkanek. Stanowi swoistą, wzmożoną i ukierunkowaną odpowiedź biochemiczną, immunologiczną oraz hematologiczną na poziomie zarówno lokalnym, jak i ogólnoustrojowym [Schuster H.P. i wsp., 1997; Karpel E. 2001; Całkosiński I. i wsp., 2009].
Pierwszy opis zapalenia i pierwsza jego klasyfikacja miała miejsce już w II w. n.e.. Przeprowadzona została przez greckiego filozofa i uczonego, Celsusa, który wyodrębnił cztery etapy stanu zapalnego, charakterystyczne dla każdego przebiegu zapalenia. Pierwsze z nich to podwyższenie ciepłoty ciała (z łac. calor) oraz zaczerwienienie (z łac. rubor), pojawiające się w pierwszej fazie zapalenia w odpowiedzi na czynnik wywołujący, jako skutek zwiększonego przepływu krwi przez miejsce objęte zapaleniem. W kolejnym etapie obserwujemy obrzęk (z łac. tumor) powstały wskutek gromadzenia się wysięku (z łac. exsudatum) i zatrzymania płynów w obrębie łożyska naczyniowego oraz ból (z łac. dolor), związany z drażnieniem odkrytych zakończeń nerwowych przez mediatory zapalenia. W późniejszych latach, jako piąty element stanu zapalnego, rzymski uczony Galen dopisał upośledzenie czynności tkanek (z łac. functio laesa) [Rather L.J., 1971], potwierdzone w późniejszym czasie przez niemieckiego badacza o polskich korzeniach, Rudolfa Virchow’a [Cotran R.S. i wsp.,1998].
Umiarkowany odczyn zapalny może przynieść korzystne skutki dla organizmu, ponieważ może wpływać na zachowanie pozytywnego bilansu pomiędzy wpływem destrukcyjnym samego procesu zapalnego a procesami przywracającymi równowagę
CZĘŚĆ TEORETYCZNA
15
narządową. Dobrym przykładem opisanego powyżej zjawiska jest m.in. zdolność do hamowania krwawienia powstałego na skutek urazu, usuwanie i neutralizowanie produktów rozkładu szczątek bakterii z egzo- i endotoksyn wraz z wysiękiem, jak również tworzenie linii demarkacyjnej ograniczającej rozprzestrzenianie się ogniska zapalnego [Całkosiński I. i wsp., 2009; Cheng T. i wsp., 2011].Przyczyny oraz czynniki wywołujące zapalenie są niezwykle zróżnicowane. Możemy postarać się je pogrupować, stosując jedeno z trzech poniżej podanych kryteriów:
Czynniki biologiczne, jako reakcja immunologiczna w odpowiedzi na antygeny własne lub obce, najczęściej wywołane zakażeniami bakteryjnymi, grzybiczymi, wirusowymi, pierwotniakowymi, zatruciem egzo- lub endotoksynami, uszkodzeniem ciągłości tkanek wraz z martwicą (odleżny, menstruacja, zawał).
Czynniki fizyczne, do najczęstszych należą: uszkodzenia mechaniczne i termiczne, promieniowanie jonizujące oraz promieniowanie ultrafioletowe UV, pole elektromagnetyczne, a także fale ultradźwiękowe.
Czynniki chemiczne, najczęściej związane z miejscowym drażnieniem tkanek, poprzez działanie: kwasów, zasad, aldehydów, w tym aldehydu mrówkowego i octowego, terpentyny, karageniny, kapsaicyny.
Ze względu na intensywność reakcji zapalnej, możemy wyszczególnić i wyróżnić: kolejne cztery kryteria: reakcję zapalną normergiczną, która jest adekwatna w stosunku do bodźca, hiper- lub hipoergiczną, odpowiednio nadmierną albo zbyt słabą, a także anergiczną, inaczej tzw. reakcję śladową, w której organizm nie może wyzwolić odpowiedzi na bodziec. Z punktu widzenia samej patofizjologii, mechanizm inicjujący przebieg zapalenia schodzi często na dalszy plan wobec występujących po nich zmianach, będących podstawą do rozwoju wielu chorób. Istotny natmiast jest charakter wieloetapowy procesu zapalnego oraz jego dynamika, rozłożona w czasie, w której możemy wyróżnić przebieg ostry lub przewlekły [Winsauer G. i de Martin R., 2007; Pham C.T., 2008].
Pierwsza faza zapalenia, zwana również fazą ostrą odczynu zapalnego, trwa od kilku sekund do 12 godzin od zadziałania bodźca, z możliwością przekształcenia się w fazę przewlekłą. W pierwszym etapie procesu będącym najczęściej fazą utajoną, dochodzi w pierwszej kolejności do wielu zmian hematologicznych. Zmiany związane z silnym rozszerzeniem łożyska małych naczyń, występują po uwolnieniu do osocza mediatorów zapalenia (m.in. histaminy, serotoniny). To skutkuje powstawaniem obrzęku, na który składa się etap dyfundowania wody do przestrzeni międzykomórkowej, a w późniejszym
CZĘŚĆ TEORETYCZNA
16
czasie również białek osocza [Winsauer G. i de Martin R., 2007]. Do kolejnych zaburzeń hemodynamicznych przy współistniejącym niedotlenieniu, dochodzi poprzez degradację śródbłonka naczyń włosowatych oraz migrację elementów morfotycznych krwi. Na tym etapie odczynu zapalnego główną rolę odgrywają trombocyty, które w następstwie pojawienia się w miejscu uszkodzenia, wydzielają aminy biogenne i czynnik aktywujący płytki (PAF), tym samym zapoczątkowując proces wykrzepiania śródnaczyniowego w miejscu powstania odczynu [Chrousos G.P., 1995; Całkosiński I. i wsp., 2007-2009; Cieślik K. I Kołaczowska E., 2012].W fazie ostrej zapalenia dochodzi również do przemian samych komórek biorących czynny udział w procesie. Najbardziej istotny w patogenezie jest proces degranulacji mastocytów, którym towarzyszy uwolnienie mediatorów stanu zapalnego zmagazynowanych w ziarnistościach w cytoplaźmie komórki. Po uwolnieniu rozprzestrzeniają się na sąsiadujące tkanki, a wraz z krwią docierają do innych organów. Na tym właśnie etapie możemy zaobserwować zmienne działanie ogólnoustrojowe odczynu zapalnego, objawiającego się m.in. obniżeniem ciśnienia tętniczego krwi pod wpływem działania histaminy, wzrostem krzepliwości krwi związanej ze znacznie podwyższonym stężeniem fibrynogenu czy wzrostem stężenia w osoczu amin katecholowych, z wyszczególnieniem adrenaliny i noradrenaliny [Chrousos G.P., 1995; Zabłocka A., 2001; Bujniewicz E., 2002]. Wraz ze wzrostem przepływu krwi i napływu limfy w miejscu występowania odczynu zapalnego, wzrasta ilość kolejno napływających elementów układu białokrwinkowego (granulocyty, makrofagi) zdolnych do fagocytozy uszkodzonych komórek i toksyn, odpowiedzialnych za cytotoksyczny odczyn komórkowy oraz odpowiedź humoralną (limfocyty T i B). Monocyty i makrofagi w zajętych zapaleniem tkankach wpływają przede wszystkim na uwalnianie cytokin, które sygnalizują innym komórkom o obecności stanu zapalnego [McGeer E.G. i wsp., 2005; Glaros T. i wsp., 2009; Gieseg S.P. i wsp., 2009; Gołąb J. i wsp., 2013].
W fazie późnej odczynu zapalenego, zauważalny jest intensywny wzrost stężenia eikozanoidów, pochodzących z degradacji błon komórkowych (w tym tromboksanu i prostaglandyn), które wraz z bradykininą (BK), acetylocholiną (Ach) i histaminą ułatwiają migrację komórek z krwi do objętej zapaleniem tkanki (zwiększenie przepuszczalności naczyń, rozkurcz mięśniówki gładkiej naczyń krwionośnych), a także wyzwalając impulsy bólowe po wcześniejszej depolaryzacji nagich zakończeń nerwowych [Dobrogowski J. i Wrodliczek J., 2004; Watkins L.R. i Maier S.F., 2005; Całkosiński I. i wsp., 2009]. Decydująca w całym procesie jest niewątpliwie rola wątroby, która w odpowiedzi na rozprzestrzeniające się zapalenie, wykraczające poza obręb jednej tkanki, wpływa
CZĘŚĆ TEORETYCZNA
17
hamująco na dalszy rozwój procesu patologicznego, poprzez wytwarzanie białek ostrej fazy, w głównej mierze białka CRP (z ang. C – reactive protein), a także kluczowych czynników biorących udział w kaskadzie krzepnięcia krwi. Stanowi także rezerwuar działających antyoksydacyjnie metali ciężkich (Fe2+, Cu2+), które pełnią istotną rolę wpoczątkowym przebiegu zapalenia [Boyer R.F. i wsp., 1983; Reilly C.A. i wsp., 1998; Prohaska J.R., 2008; White C., i wsp., 2009].
Ryc.1. Proces powstawania ogniska zapalnego [Opracowano na podstawie pracy: Całkosiński I. i wsp., 2007-2009]
Utrzymujący się stan zapalny może skutkować również przerostem tkanek, wystepującym najczęściej po uszkodzeniu i odkryciu włókien kolagenowych, co doprowadza do zmiany funkcji narażonej tkanki. Powyższe zjawisko ma najczęściej miejsce po zapoczątkowaniu migracji komórek o działaniu prozapalnym w miejsce uszkodzenia. Fibroblasty, reprezentujące jedną z najliczniej uczestniczacych w tym etapie grup komórek, po wcześniejszej aktywacji przez uwolnione cytokiny i prostaglandyny, rozpoczynają syntetyzować, de novo, włókna kolagenowe oraz glukozaminoglikany, stanowiące zrąb nowo powstającej tkanki łącznej o charakterze zwyrodnieniowym [Mitchell R.N. i Cotran R.S., 1997; Maharaj C. i Laffey J.G., 2004; Barrientos S. i wsp., 2008].
CZĘŚĆ TEORETYCZNA
18
Ogólny proces powstania ogniska zapalnego składają się kolejno odpowiedzi: typu humoralnego, w której pojawiają się kolejno mediatory zapalenia w płynach ustrojowych, typu hemostatycznego, opisana powyżej oraz typu immunologicznego związana z aktywacją układu dopełniacza, syntezą przeciwciał, interferonów oraz interleukin został przedstawiony na Ryc. 1. [Całkosiński I. i wsp., 2007 - 2009].2.2.
B
ÓL WP
RZEBIEGUZ
APALENIAWedług definicji prof. Jerzego Wrodliczka bazującej na definicji Międzynarodowego Stowarzyszenia Leczenia Bólu (IASP, z ang. International Association for the Study of Pain) : „ból, nieodłączny w życiu każdego człowieka, spełnia szereg ważnych fizjologicznych funkcji poznawczych, ostrzegających i ochronnych. Jest doznaniem czuciowym związanym zarówno z działaniem bodźca, którego działanie może powodować uszkodzenie tkanki lub organu, ale także może się pojawić jako spostrzeżenie na podstawie psychicznej interpretacji zachodzących zjawisk, zmodyfikowanych przez wcześniejsze doświadczenia. Stąd stanowi funkcję indywidualną i subiektywną” [Wrodliczek J. i Dobrogowski J., 2007].
Rozbudowany system neuronów skupiających się w nerwach czuciowych i przewodzących stanowi dynamiczny i niezwykle złożony układ nocyceptywny (z łac. nocere – szkodzić). Jego zadaniem jest przewodzenie bodźców, będących informacją o zadziałaniu czynników szkodliwych i zaburzających hemostazę w tkankach obwodowych i przekazywanie jej do rdzenia kręgowego i dalszych struktur mózgu. W odpowiedzi na przetworzoną informację bólową, uaktywniają się mechanizmy kompensujące, które ograniczają siłę i czas trwania bólu [Wrodliczek J. i Dobrogowski J., 2007; Filypczyk-Bryniarska I. i wsp., 2010]. Za odbieranie wrażeń bólowych i przekształcanie bodźców drażniących na impuls elektryczny, odpowiadają nocyceptory, rozmieszczone na wolnych zakończeniach nerwowych, znajdujących się w skórze i w tkance podskórnej, tkance łącznej, nerwach układu współczulnego unerwiającego trzewia i narządy miednicy mniejszej [Żylicz Z. i Krajnik M., 2003; Dobrogowski J. i Wrodliczek J., 2004].
Nocycepcję, stanowiącą proces powstawania odczucia bólowego, jego przewodzenie i dalsze przetwarzanie przez wyższe struktury w mózgu, możemy podzielić na 4 kolejne etapy (Ryc.2):
CZĘŚĆ TEORETYCZNA
19
- transdukcję (zmiana energii bodźca drażniącego na impuls elektryczny)- transmisję (przewodzenie powstałego impulsu do struktur OUN) - modulację (pobudzanie lub hamowanie, sumowanie bodźców) - percepcję (ostateczna emocjonalna ocena bólu).
Ryc.2. Klasyczny szlak nocycepcji [wg Wrodliczek J. i Dobrogowski J., 2004]
Informacja o zadziałanym bodźcu w układzie nocyceptywnym odbywa się dzięki dwóm rodzajom włókien nerwowych: szybkich i zmienilizowanych włókien typu Aδ oraz wolnych i nagich włókien typu C. Te ostatnie posiadają na swoich zakończeniach różne receptory, w tym receptory opioidowe, których nie ma na włóknach typu Aδ [Schmelz M. i wsp., 1994]. Większość z wbudowanych w błonę komórkową receptorów opioidowych jest nieaktywna, a do ich aktywacji może się przyczynić rozwijający się proces zapalny. Co ciekawe, może również wpływać na zwiększoną syntezę nowych receptorów w tkance objętej zapalniem, które po uwrażliwieniu mogą reagować na endo- i egozgenne opioidy [Krajnik M. i Żylicz Z., 2003; Sharp B.M., 2006; Filipczak-Bryniarska I. i wsp., 2010].
CZĘŚĆ TEORETYCZNA
20
Ból przewlekły jest konsekwencją narażenia organizmu na urazy, uszkodzenie układu nerwowego albo w przebiegu chorób, u podłoża których leży proces zapalny. Ból zwykle pojawia się po pewnym czasie, utrudniając tym samym ustalenie lokalizacji uszkodzenia, jak również niejednokrotnie stwarza problem ze znalezieniem jego przyczyny [Filipczak-Bryniarska I. i wsp., 2010]. Jednakże etiopatogeneza powstawania wrażeń bólowych w większości przypadków przebiega podobnie. W pierwszym etapie zapalenia, z uszkodzonych tkanek zostają uwolnione mediatory bólu, do których należy m.in. histamina, serotonia (5-HT) i bradykinina (BK) [Rueff A. i wsp., 1994; Dray A., 1995], a ich uwolnienie wiąże się z aktywacją włókien afarentnych Aδ i C. Poprzez zwiększony napływ do komórki jonów K+, dochodzi dohiperpolaryzacji błony komórkowej neronów i transmisji informacji nocyceptywnej do OUN [Dray A., 1995]. W dalszym etapie uwalniane zostają kolejne mediatory zapalenia i bólu (substancja P, prozapalne cytokiny, prostanoidy), które na zasadzie dodatniego sprzężenia zwrotnego wpływają na ponowne uwalnianie substancji P (sP). W połączeniu z rozszerzeniem łożyska naczyniowego i zwiększeniem przepuszczalności naczyń krwionośnych doprowadzają do zjawiska nazywanego „pierwotną hiperalgezją” wiążącą się z nadwrażliwością na ból w miejscu odczynu zapalnego, a w najcięższych przypadkach nawet z wystapieniem zjawiska allodynii [Maśliński S., 1998; Watkins L.R. i Maier S.F., 2005; Wrodliczek J. i Dobrogowski J., 2007; Loeser J.L. i wsp., 2008].
2.3.
W
YBRANEM
EDIATORYB
ÓLU IZ
APALENIAKluczową rolę w funkcji obronnej organizmu oraz systemu wczesnego ostrzegania przed zagrożeniem pełnią liczne chemiczne czynniki humoralne, produkowane w wysokiej mierze przez komórki układu immunologicznego, stanowiące tzw. element komórkowy odpowiedzi zapalnej. Do tych komórekzaliczamy m.in. monocyty, makrofagi, granulocyty i limfocyty B, T i NK wytwarzane w narządach układu immunologicznego (grasica, śledziona) lub rozsianych po organizmie grudkach chłonnych, które następnie na drodze para- lub endokrynnej, docierają wszędzie tam, gdzie niezbędna jest obrona przed szkodliwym czynnikiem [Karpel E., 2001; Sochacka M. i Błach-Olszewska Z., 2005; Gołąb J. i wsp., 2013].
CZĘŚĆ TEORETYCZNA
21
Niezależnie od drogi aktywacji i czynnika wywołującego zapalenie, przebieg pierwotnego mechanizmu obrony dzielimy na fazę prozapalną, w której kluczową rolę odgrywa czynnik martwicy nowotworu - TNF-α, oraz fazę przeciwzapalną, w której najistotniejszą funkcję posiadają rozpuszczalne receptory dla TNF-α i IL-1 [Robak T., 1991-1995; Dinarello C.C.A., 1997].Mediatory zapalenia możemy podzielić na dwie grupy, niezależnie od czynnika aktywującego, jak i fazy odczynu, na (Ryc.3):
- mediatory osoczowe, do których zaliczymy układ krzepnięcia krwi, układ dopełniacza i układ kininowy, posiadające istotne funkcje fizjologiczne (m.in. procesy gojenia się ran i tamowanie krwotoku),
- elementy komórkowe wpływające na wytwarzanie czynników chemicznych, tj. pochodne kwasu arachidonowego (neutrofile), histamina (mastocyty) czy serotonina (trombocyty) [Karpel E., 2001].
CZĘŚĆ TEORETYCZNA
22
2.3.1. CytokinyJak już wspomniano na wstępie, pierwotnym mediatorem reakcji zapalnej pojawiającym się już we wczesnej fazie zapalenia jest prozapalny TNF-α, któremu często towarzyszy IL-1. Pojawiają się one po zaktywowaniu komórek monocytów i makrofagów zaraz po ekspozycji organizmu na czynnik szkodliwy i zapoczątkowują lawinę działań mających na celu zatrzymanie odczynu zapalnego i przywrócenie homeostazy [Robak T., 1991-1995; Dinarello C.C.A., 1997; Haverman J.W. i wsp., 1999]. Cytokiny wpływają prawdopodobnie na wszystkie fazy odpowiedzi immunologicznej, zarówno humoralnej jak i komórkowej. Jako białka hormonopodobne regulują proliferację, różnicowanie i aktywację komórek biorących udział w procesie zapalenia, wliczając komórki NK (z ang. Natural Killer), granulocyty, monocyty i makrofagi. Z drugiej strony wpływaja na ilość i rodzaj przeciwciał, po wcześniejszej aktywacji limfocytów typu B oraz typu T [Robak T., 1995; Sochacka M. i Błach-Olszewska Z., 2005]. Ze względu na sposób działania cytokin, podzielono je na grupy funkcjonalne o podobnym, ale nie identycznym działaniu i jego efekcie:
- pierwszą grupę stanowią mediatory reakcji odpornościowych, mające za zadanie przekazywanie sygnału do sąsiednich komórek, stymulując komórki do produkcji wtórnych przekaźników (TNF-α, IL-1, IL-6, IL-8 oraz IF typu I),
- drugą grupę stanowią cytokiny prozapalne, mające za zadanie stymulację układu odpornościowego do produkcji przeciwciał przez limfocyty typu B, produkcję białek ostrej fazy w wątrobie i wywołanie ogólnego stanu zapalnego (IF typu II, IL-1β, TNF-α, IL-15, IF-γ),
- cytokiny przeciwzapalne produkujące rozpuszczalne receptory cytokin prozapalnych, wykazując tym samym działanie supresyjne do wcześniejszych (TNF-α, IL-4, IL-10 i IL-13).
- osobną grupę stanowią cytokiny odpowiedzialne za proliferację i wzrost komórek układu immunologicznego, jak również komórek macierzystych szpiku kostnego (m.in. IL-6, CSF, EDF, TGF, IL-12) [Robak T., 1991-1995; Karpel E., 2001; Łukaszewicz M i wsp., 2007; Gołąb J. i wsp., 2013].
CZĘŚĆ TEORETYCZNA
23
2.3.2. PAFCzynnik aktywujący płytki krwi (z ang. platelet – activating factor, PAF) jest naczynioruchowym i chemotaktycznym mediatorem wytwarzanym przez komórki tuczne, monocyty, makrofagi oraz leukocyty (z wyłączeniem limfocytów) na skutek bodźca drażniącego komórkę [Yost C.C. i wsp., 2011]. Do jego istotniejszych zadań w przebiegu zapalenia należy pobudzenie monocytów i makrofagów do produkcji prozapalnej cytokiny TNF-α, uwalniania aktywnych form tlenu i aktywacja układów enzymów lizosomalnych w neutrofilach Posiada aktywny udział w produkcji eikozanoidów i metabolizmu kwasu arachidonowego [Prescott S.M. i wsp., 2000; Ishii S. i wsp., 2002]. Kluczową rolę w aktywacji i rozpoczęciu kaskady przekazywania sygnału stanowią receptory sprzężone z białkiem G, dla których PAF i podobne do niego mediatory lipidowe stanowią substrat (PAFRs, z ang. Platelet – Activating Factor Receptors) [Schimizu T., 2009]. Głównym ich zadaniem jest pobudzenie ekspresji białek w kluczowych dla funkcji obronnej organizmu komórkach, biorących udział m.in. w zapaleniu, odpowiedzi immunologicznej humoralnej i komórkowej, a także w procesie hemostazy [Ishii S. i wsp., 2002; Schimizu T., 2009].
Zgodnie z powyższym, wraz ze wzrostem jego stężenia możemy zaobserwować zwiększoną przepuszczalność naczyń krwionośnych, zmniejszenie ciśnienia krwi oraz skurcz oskrzeli. Dodatkowo przesuwa neutrofile do komórek śródbłonka, nasila ich migrację oraz stanowi dla nich silny czynnik chemotaktyczny, podobnie jak w przypadku eozynofilii. Zwiększoną aktywność PAF zauważono w odpowiedzi zapalnej na poziomie ogólnoustrojowym, która często ze względu na patologiczną i niekontrolowaną odpowiedź organizmu może doprowadzić do jego trwałego uszkodzenia lub nawet do śmierci [Mathiak G. i wsp., 1997; Alberti C. i wsp., 2005]. Mechanizmem obronnym przed nadmiernym wytwarzaniem lipidowych czynników aktywujących płytki, tym samym ograniczenie łączenia się z odpowiednim receptorem błonowym lub jądrowym, jest obecna, zarówno w środowisku komórkowym, jak również poza nim fosfolipaza A2, znana jako
acetylohydrolaza PAF (PAF AH), której działanie w tym przypadku ma też charakter przeciwzapalny[Karasawa K., 2006].
CZĘŚĆ TEORETYCZNA
24
2.3.3. ElastazaGłównym enzymem proteolitycznym wytwarzanym przez białe krwinki, w tym w głównej mierze neutrofile w odpowiedzi na bodziec zapalny, jest hydrolaza serynowa – elastaza [Dewald B. i wsp., 1975]. Po aktywacji leukocytów przez m.in. endotoksynę, PAF lub cytokiny, podczas procesu fagocytozy hydrolizuje ona połączenia peptydowe w obcych białkach, doprowadzając do ich degradacji i strawienia przez komórki żerne [Mohr W. i Wessinghage D., 1978; Cohen M.S., 1994; Johansson S. i wsp., 2002]. Dezaktywacja tego enzymu jest możliwa dzięki obecności naturalnie występujących inhibitorów, do których należy m.in. α1- antytrypsyna [Beatty K. i wsp., 1980; Travis J. i Salvesen G.S., 1983].
Nadmierne pobudzenie i stymulacja neutrofili przez mediatory zapalenia, jak również brak wystarczającej ilości naturalnie występujących inhibitorów elastazy [Bieth J.G., 1984; Weitz J.I. i wsp., 1987; Dziedziczko A. i wsp., 2004], może skutkować uszkodzeniem kluczowych, biologicznie aktywnych protein błon komórkowych, degradacją tkanki łącznej i doprowadzeniem do rozprzestrzeniania się zapalenia na sąsiadujące tkanki [Beatty K. i wsp., 1980; Cohen M.S., 1994; Mitchell R.N. i Cotran R.S., 1997]. Brak skutecznej obrony przed nadmierną aktywacją enzymu może być przyczyną wielu groźnych chorób o podłożu zapalnym, tj. reumatoidalne zapalenie stawów (RZS), mukowiscydoza, zespoły zaburzeń oddechowych, skutkujące w niektórych przypadkach nawet ostrym uszkodzeniem płuc [McGuire W. i wsp., 1982; Janoff A., 1985; McPhail L.C. i wsp., 1992; Lee W.L. i Downey G.P., 2001; Demkov U. i van Overveld F.J., 2010].
2.3.4. Układ dopełniacza
Dopełniacz (z ang. complement) to określenie na układ składający się z około 40 białek odpornościowych osocza krwi i pozostałych płynów ustrojowych, który jest aktywowany w toku szybkiej enzymatycznej reakcji kaskadowej [Zipfel P.F. i wsp., 2006; Caroll M.C., 2008; Gołąb J. i wsp., 2013]. Glikoproteiny tego układu wytwarzane są przede wszystkim przez monocyty i komórki wątroby, na skutek obecnościtoksyn bakteryjnych, kompleksów immunologicznych antygen – przeciwciało, ale także osoczowych mediatorów odczynu zapalnego (układu kininowego, czynników krzepnięcia krwi i fibrynolizy). Możliwe są trzy drogi pobudzenia dopełniacza: klasyczna, alternatywna lub lektynowa, jednakże w przypadku każdej z wyżej wymienionych dochodzi do utworzenia dwóch najistotniejszych enzymów: konwertazy C3 i C5, które wzmacniają efekt pobudzenia i doprowadzają do utworzenia kompleksu atakującego błonę MAC (z ang.
CZĘŚĆ TEORETYCZNA
25
Membrane Attacking Complex) [McGeer E.G. i wsp., 2005; Wust S.K. i wsp., 2006; Male D. i wsp., 2012]. Kompleks ten odpowiedzialny jest za powstawanie kanałów transbłonowych w komórkach, powodując wypływ z wnętrza komórki jonów, ATP i substancji odżywczych. Równocześnie, ze względu na podwyższone ciśnienie osmotyczne, do komórki napływa woda, mogą dostawać się naturalne czynniki bakteriobójcze i bakteriostatyczne (np. lizozym), jak również antybiotyki [Gołąb J. i wsp., 2013; Male D. i wsp., 2012].Do głównych zadań układu dopełniacza, poprzez stymulację odpowiedzi immunologicznej organizmu należą m.in.:
- bezpośrednia liza komórek patogenów (bakterii i wirusów) poprzez kompleks atakujący błonę
- bezpośrednia aktywacja komórek tucznych, pobudzając ich degranulację i uwolnienie mediatorów zapalenia (głównie histaminy), rozpoczynając fazę ostrego zapalenia. W miejscu toczącego się zakażenia zwiększa się przepływ krwi oraz przepuszczalność naczyń krwionośnych, ułatwiając przechodzenie przez śródbłonek naczyń mediatorów odczynu zapalnego i granulocytów
- chemotaksja komórek o właściwościach żernych do miejsca zapalenia (przede wszystkim neutrofili) i aktywacja fagocytów, przez co możliwa jest opsonizacja drobnoustrojów, a następnie transport tak powstałych kompleksów immunologicznych do wątroby i śledziony oraz ich neutralizacja przez komórki żerne
- eliminacja zmodyfikowanych lub uszkodzonych komórek gospodarza
- hamowanie precypitacji kompleksów antygen – przeciwciało [Zipfel P.F. i wsp., 2006; Klaska I. i Nowak J.Z., 2007; Male D. i wsp., 2012; Gołąb J. i wsp., 2013].
Nadmierna aktywacja układu dopełniacza i różnego rodzaju zaburzenia w jego funkcjonowaniu mogą być niezwykle niebezpieczne, prowadząc do uszkodzenia komórek gospodarza, tym samym powodując zapadalność na wiele różnych chorób, w większości o podłożu zapalnym [Roitt I. i wsp., 2000; Nowak J.Z. i Waszczyk M., 2006]. Niewłaściwe funkcjonowanie układu dopełniacza powiązano m.in. z zakażeniami bakteryjnymi, niektórymi nowotworami, zapaleniem i ostrą niewydolnością nerek, zwyrodnieniem plamki żółtej i zaburzeniami procesów widzenia, niektórymi chorobami neurodegeneracyjnymi, w tym chorobą Alzheimera, RZS, zespołem hemolityczno-mocznicowym czy zespołem antyfosfolipidowym [Nowak J.Z., 2005 - 2006; Nowak J.Z. i Waszczyk M., 2006; Klaska I. i Nowak J.Z., 2007].
CZĘŚĆ TEORETYCZNA
26
2.3.5. Układ kalikreina – kininyUkład kalikreina-kininy stanowi jeden z pierwszych elementów wewnątrzpochodnego mechanizmu krzepnięcia krwi oraz układu odpornościowego organizmu, którego nieznaczna aktywacja może wywierać korzystny wpływ na działający miejscowo bodziec uszkadzający [Bhoola K.D. i wsp., 1992; Żelawski W. i wsp., 2005]. Towarzyszące zapaleniu przerwanie ciągłości ścian naczyń krwionośnych oraz krwawienie, powoduje aktywację kaskadową wielu różnych czynników i białek, celem której jest finalnie powstanie czynnego fibrynogenu, który pod wpływem trombiny przekształci się w fibrynę. Na tym etapie powstaje najważniejszy czynnik procesu krzepnięcia, uniemożliwiający dalsze wynaczynienia krwi z łożyska naczyniowego i wykrwawienie [Majno G. i Joris I., 2004].
Autokoidem o najważniejszej funkcji w tym układzie jest niewątpliwie bradykinina (BK) – peptyd składający się z 9 aminokwasów, powstały na skutek działania proteazy serynowej – kalikreiny osoczowej, na kininogen wielkocząsteczkowy, będący osoczowym białkiem, α1–globuliną [Marceau F.A. i wsp., 1983; Bhoola K.D. i wsp., 1992].
W tkankach w większym stężeniu, aniżeli w osoczu krwi, obserwuje się kalikreinę tkankową, dla której substratem jest przede wszystkim tzw. kininogen drobnocząsteczkowy. Po jego degradacji zostaje uwolniony peptyd składający się z 10 aminokwasów, kalidyna, ulegająca przemianie do bradykininy [Bhoola K.D., 1992]. Zarówno kalidyna, bradykinina, jak i jej pochodna des-9-Arg-bradykinina wywierają działanie zapalne poprzez swoiste receptory dla bradykininy - BK1 oraz BK2 [Roberts R.A. i wsp., 1989; Hess J.F. i wsp., 1992]. Ekspresja pierwszego z nich zwiększa się na powierzchni komórek gromadzących się w ognisku nacieku zapalnego [Roberts R.A.i wsp., 1989]. Charakterystyczna jest przede wszystkim dla przewlekłego zapalenia, w którym obserwujemy zwiększoną syntezę kolagenu podczas proliferacji fibroblastów w procesie zapoczątkowującym proces włóknienia [Maharaj C. i Laffey J.G., 2004; Barrientos S. i wsp., 2008]. Głównym objawem działania kinin zarówno poprzez receptor BK1 jak i BK2 jest często ostry ból, spowodowany obniżeniem przez BK progu bólowego poprzez depolaryzację zakończeń nerwów czuciowych, jak również stymulację powstawania eikozanoidów, biorących również czynny udział w reakcji bólowej i zapalnej [Burh R.M i wsp., 1989; Całkosiński I. i wsp., 2009]. Poza tym, BK jako mediator ostrej fazy zapalenia, może wywoływać ból poprzez aktywację receptora BK2, głównie związany z uwalnianiem za jej pośrednictwem, m.in. sP, CGRP (z ang. calcitonine gene-related peptide -
CZĘŚĆ TEORETYCZNA
27
peptyd związany z genem kalcytoniny) i neurokininy A. Działanie BK na łożysko naczyniowe jest bardzo zbliżone do działania histaminy: następuje silne rozszerzenie naczyń i zwiększony dopływ krwi do miejsca objętego zapaleniem, co za tym idzie – zwiększona migracja leukocytów, jak również zwiększona przepuszczalność naczyń włosowatych, dzięki czemu dochodzi do wysięku białek zawartych w surowicy i powstawania obrzęku [Burh R.M. i wsp., 1989; Rojkjaer R. i Schmaier A.H., 1999; Gryglewski R.J. i wsp., 2001; Schmaier A.H., 2008; Schulze-Topphoff U. i wsp., 2008].2.3.6. NF-κB
Komórkowy czynnik transkrypcyjny NF-κB jest decydującym regulatorem szybkiej odpowiedzi na obecność patogenu. Odgrywa ważną rolę w promocji apoptozy, zapalenia, w procesach odporności, zarówno właściwej jak i nabytej [Karin M. i Ben-Neriah Y., 2000; Li Q,, 2002; Casseli E. i wsp., 2007; Lawerence T. i Fong C., 2009; Atkinson G.P. i wsp., 2010; Niederberger E. i Geisslinger G., 2010]. NF-κB po raz pierwszy został opisany w 1986 r. jako czynnik odgrywający istotną rolę w procesach odpornościowych oraz zapalnych [Sen R. i Baltimore D., 1986]. Jako czynnik jądrowy wiąże się z promotorem genu łańcucha lekkiego κ immunoglobulin w dojrzałych limfocytach B [Ahn K.S. i Agarrwal B.B., 2005]. NF-κB występuje w postaci nieaktywnego kompleksu związanego z białkiem z rodziny IKB. Indukcja kompleksu zachodzi w odpowiedzi na różne czynniki, tj. promieniowanie UV, infekcje bakteryjne i wirusowe, ale także narażenie i wystawienie na prozapalne cytokiny i mitogeny [Yamamoto Y. i Ganyor R.B., 2001, Santoro M.G. i wsp., 2003, Casseli E. i wsp., 2007].
Aktywacja kompleksu NF-κB może zachodzić różnymi ścieżkami transdukcji sygnału, w zależności od indukującego bodźca, choć najczęściej dotyczy kompleksu IKK [Karin M. i Ben-Neriah Y., 2000; Casseli E. i wsp., 2007] (Ryc. 4). IKK to kompleks kilku podjednostek, z których dwie posiadają działanie katalityczne – IKKα oraz IKKβ, a trzecia stanowi białko regulatorowe – IKKγ (NEMO). Białko IKKγ pełni funkcję „dokującą” dla licznych białek, występujące w wielu typach komórek i jest niezbędne w celu aktywacji NF-κB po zadziałaniu m.in. czynnika martwiczego nowotworu (TNF-α), ludzkiego wirusa białaczki z komórek T typu 1 (HTLV1, z ang. human T – lymphotropic virus 1), lipopolisacharydu (LPS) [Suh S.J., 2007] czy poprzez bezpośredni wpływ na receptory dla limfocytów T (TCR) [Karin M. i Ben-Neriah Y., 2000; Karin M. i Lin A., 2002; Schifere A.S., 2010].
CZĘŚĆ TEORETYCZNA
28
Kompleks NF-κB ulega aktywacji poprzez fosforylację podjednostek inhibitora w miejscu wiązania ubikwityny, która prowadzi do degradacji połączenia podjednostek przez 26S proteazę [Ryan K.M. i wsp., 2000]. Uwolnione dimery NF-κB następnie ulegają translokacji do jądra i wiążą się ze stałą sekwencją DNA promotora (elementem κB), aktywując w ten sposób transkrypcje wielu genów związanych m.in. z odpowiedzią zapalną, tj. cząstek adhezyjnych komórek, prozapalnych i chemotaktycznych cytokin oraz receptorów dla tych cytokin, jak również enzymów produkujących mediatory zapalenia – COX-2 oraz iNOS [Li Q.,2002; Casseli E. i wsp., 2007; Jost P.J. i Rulad J., 2007]. Jednakże wiele z prozapalnych genów cytokin wymaga dużej liczby czynników transkrypcyjnych w celu aktywacji procesu transkrypcji oraz uzyskania maksymalnej ekspresji dla tych genów [Balkwill F., 2004].Rodzina NF-κB to: RelA (p65), c-Rel, RelB, p50 i p52, które łącząc się pomiędzy sobą tworzą różne kompilacje heterodimerów, ale tylko trzy pierwsze z nich posiadają domeny aktywujące proces transkrypcji, z przeważającą rolą kompleksu p65/p50 [Hoffmann A.,2003; Hagemann T. i wsp., 2009].
Ryc. 4 . Klasyczny szlak aktywacji czynnika NF-κB [Opracowano na podstawie pracy: Marihno H.S. i wsp., 2014]
CZĘŚĆ TEORETYCZNA
29
2.3.7. Receptory Toll-likeW latach 90-tych ubiegłego wieku po raz pierwszy w magazynie Cell ukazał się artykuł o istnieniu wyspecjalizowanych białek receptorowych Toll biorących udział w odpowiedzi przeciwgrzybiczej u człowieka [Lemaitre B. i wsp., 1996], a które po raz pierwszy odkryto u muszki owocowej (Drosophila melanogaster Sp.) pod koniec lat 80-tych [Hashimoto C. i wsp., 1988]. W roku 1997 ukazał się ciekawy, a zarazem przełomowy artykuł, w którym po raz pierwszy zidentyfikowano i opisano ludzki gen będący homologiem genu kodującego białko Toll muszki owocowej, po czym receptor nazwano Toll-podobny (z ang. Toll-like receptor, TLR) [Medzhitov R. i wsp., 1997]. Receptory obecne są przede wszystkim na komórkach stanowiących broń w pierwszym etapie infekcji, jak komórki dendrytyczne, tuczne oraz makrofagi, gdy reakcja organizmu musi być natychmiastowa i nie ma możliwości angażowania limfocytów do produkcji przeciwciał.
Rodzina receptorów Toll-podobnych funkcjonujących w obrębie odporności wrodzonej u człowieka, stanowi pierwszą linię obrony organizmu w rozpoznawania molekularnych struktur zarówno powierzchniowych, jak i wewnętrznych drobnoustrojów (z ang. Pathogen-Associated Molecular Patterns, PAMPs) (Tabela 1). Ich aktywacja prowadzi do uruchomienia ważnych mechanizmów efektorowych odporności wrodzonej, a w kolejnych etapach uczestniczą również w kształtowaniu odporności nabytej, związanej przede wszystkim z pobudzeniem wytwarzania cytokin pro- jak i przeciwzapalnych [Takeda K. i Akira S., 2005; Pasare C. i Medzchitov R., 2005; O’Neill L.A., 2006; Kelian T., 2006]. Receptory Toll-podobne, których geny u człowieka zidentyfikowano w ilości 10 [Beutler B. i wsp., 2003], różnią się między sobą przede wszystkim pod względem komórek, na których ulegają ekspresji, szlakiem wewnątrzkomórkowego przekazywania sygnału, specyficzności ligandu (Ryc. 5.) który łączy się z receptorem, i tym samym typem odpowiedzi immunologicznej, które wywołują [Guo L.-H. i Schluesener H.J., 2011]. Wspólną cechą większości dotąd poznanych receptorów Toll-podobnych, z wyjatkiem TLR3, jest oddziaływanie poprzez białko adaptorowe MyD88 (z ang. Myeloid Differentiation Primary Response Protein 88) i dalej szlakiem aktywacji NF-κB (Ryc.6.) (Roz.1.3.6.).
TLR to transbłonowe białka posiadające w swojej budowie dwie charakterystyczne domeny: zewnątrzkomórkowa domena występująca na N-końcu receptora zawiera powtórzenia bogate w leucynę (z ang. leucine rich repeats, LRR), jak również regiony bogate w cysteinę. Wewnątrzkomórkowa domena występująca na C-końcu białka wykazuje niezwykle wysokie podobieństwo do domeny występującej w receptorach dla IL-1 i podobnie jak ona nie posiada właściwości enzymatycznych.
CZĘŚĆ TEORETYCZNA
30
Połączenie typu Toll/IL-1R (TIR) jest jedną z najstarszych ewolucyjnie domen i odpowiada za interakcję białko-białko (Ryc. 5.) [Akira S., 2003; Takeda K. i Akira S., 2004].
Ryc. 5. Budowa oraz ogólny schemat szlaku przekazywania sygnału przez receptory Toll-like [Akira S., 2003]
Liczne badania wskazują na kluczową rolę TLR w powstawaniu i na sam przebieg przewlekłego zapalenia i bólu poprzez aktywację mikrogleju. Następuje to poprzez wytwarzanie prozapalnych cytokin oraz białek adhezyjnych, prowadząc do sensytyzacji centralnego układu nerwowego i powstawania zjawiska hiperalgezji [Olson J.K. i Miller S.D., 2004; Jack C.S. i wsp., 2005; McMahon S.B i wsp., 2005; DeLeo J.A. i wsp., 2006]. Receptorami odpowiedzialnymi za modulację bólu w procesie zapalenia są najprawdopodobniej TLR1/2 (często występują wspólnie – są powiązane fizycznie i funkcjonalnie) [Ozinsky A. i wsp., 2000; Peng Y. i Zhang L., 2014], TLR3 oraz TLR4, któremu przypisuje się najwieksze znaczenie w procesie powstawania bólu przewlekłego i neuropatycznego [Nicotra L. i wsp., 2012; Liu T. i wsp., 2012a; Sauer R.S. i wsp., 2014].
CZĘŚĆ TEORETYCZNA
31
Ryc.6. Rózne szlaki aktywacji receptorów Toll-podobnych: TLR2, TLR4 oraz TLR3 w komórkach mikrogleju rdzenia kręgowego w przebiegu powstawania bólu przewlekłego [Liu T. i wsp., 2012a].
Po podaniu LPS, będącego naturalnym ligandem dla TLR4 odnotowano znacznie zwiększoną ekspresję genu dla tego receptora, jak również uwolnienie prozapalnych cytokin, m.in. TNF-α, IL-1β oraz IL-6 [Raghavendera V. i wsp., 2004; Lan L.S. i wsp., 2010], aktywację komórek dendrytycznych mikrogleju w centralnym układzie nerwowym [Rivest S., 2003]. Tramullas i wsp. [2014] powiązali w jednym z badań zwiększoną ekspresję TLR4 oraz zwiększone stężenia prozapalnych cytokin z silną aktywacją komórek mikrogleju w korze przedczołowej, a po podaniu zwierzętom specyficznego antagonisty receptora, TAK-242, odnotowano statystycznie istotne zmniejszenie odczuwania bólu przez zwierzęta. Zwiększona ekspresja TLR2 i TLR4 oraz poziom IL-1β, w jednojądrzastych komórkach krwi obwodowej może stanowić potencjalny biomarker w oznaczaniu bólu przewlekłego [Kwok Y.H. i wsp., 2013] Również w badaniach z udziałem TLR3 oraz TLR7/8 oznaczono wyższe poziomy cytokin prozapalnych w rdzeniu kręgowym po podaniu odpowiednich dla tych receptorów ligandów (LPS, polyIC oraz R848) [Su Y. i wsp., 2005; Zhang Z. i wsp., 2005, Meng L. i wsp., 2010], a po podaniu agonistów
CZĘŚĆ TEORETYCZNA
32
dla TLR2 oraz TLR6 (Tabela 1) odnotowano zwiększoną syntezę cytokin, które w połączenu z niedotlenieniem tkanek prowadziły do uogólnionego odczynu zapalanego [Kuhlicke J. i wsp., 2007; Koch A. i wsp., 2012].Tabela.1. Wykaz receptorów Toll-podobnych zlokalizowanych u człowieka wraz z ligandami zewnątrz- oraz wewnątrzpochodnymi [Tsan M.F. i Gao B., 2004; Takeda K. i Akira S., 2004].
TLR Ligand
TLR1 Lipopeptydy
TLR2 Lipopeptydy, lipoproteiny
Glikolipidy (m.in., β-glukan)
Białka szoku cieplnego (m.in. HSP60, HSP70, HSPGp96) Nasycone kwasy tłuszczowe
Zymosan Atypowy LPS LTA
Lipoarabinomannan
TLR3 Podwójna nić wirusowego kwasu dsRNA
polyIC
TLR4 LPS
Taksol RSV1, MMTV2
Białka szoku cieplnego (m.in. HSPGp96, HSP60, HSP70, HSP90)
Nasycone kwasy tłuszczowe Fibronektyna Fibrynogen Siarczan heparyny Kwas hialuronowy Surfaktant A TLR5 Flagelina TLR6 Zymosan LTA Lipopeptydy
TLR7 Jednoniciowy wirusowy kwas RNA
polyIC
TLR8 Jednoniciowy wirusowy kwas RNA
polyIC
TLR9 Niemetylowane reszty CpG DNA
TLR11 E. coli
CZĘŚĆ TEORETYCZNA
33
2.4.
A
KTYWNOŚĆP
RZECIWBÓLOWA IP
RZECIWZAPALNAK
WASUO
LEANOLOWEGO IJ
EGOP
OCHODNYCHW ostatnich latach pojawiło się wiele doniesień i prac badawczych wskazujących na wielokierunkowe działanie farmakologiczne pochodnych kwasu oleanolowego. Związek ten należący do triterpenów pentacyklicznych, które obok steroli, saponin i glikozydów sercowych tworzą grupę tzw. triterpenoidów. Stanowią jedną z najliczniejszych oraz najszerzej występujących grup związków chemicznych w świecie organicznym, ciesząc się dużym zainteresowaniem wielu ośrodków badawczych w zakresie fitochemii i farmakologii. Ze względu na cenne właściwości lecznicze, kwas oleanolowy i jego pochodne pozyskuje się bezpośrednio z części roślin bogatych w pochodne triterpenowe (kora, żywica, skórka i wosk ochronny liści i kwiatów) [Mailard M. i wsp., 1992; Jager S. i wsp., 2009] szczególnie należących do rodziny Oleaceae [Allouche Y. i wsp., 2009]. Największym poznanym do tej pory źródłem kwasu oleanolowego jest oliwa z oliwek (Olea europea L.) [Juan M.E. i wsp., 2006; Allouche Y. i wsp., 2009; Sporn M.B. i wsp., 2011], skąd wzięła się również nazwa związku [Simonsen J. i wsp., 1957]. Warto wspomnieć również o jemiole pospolitej (Viscum album L.) oraz nagietku lekarskim (Calendula officinalis L.) [Ruszkowski D. i wsp., 2006], bedacych jednymi z bardziej popularnych gatunków wystepujacych na terenie kraju, również bogatych w pochodne oleananu (Tabela 2).
Pochodne kwasu oleanolowego w środowisku roślinnym występują najczęściej w postaci wolnej w nadziemnych partiach roślin, w głównej mierze w liściach i woskach roślinnych [Li J., 2002] (Tabela 2), stanowiąc tym samym istotny element ochronny przed utratą wilgoci, jak również pierwszą linię obronną przed zagrożeniem ze strony patogenów [Heinzen R.A. i wsp., 1996]. W liściach oliwnych w badaniach mikroskopowych można dostrzec kryształki wolnego kwasu, który stanowi fizyczną barierę przeciwko patogennym grzybom [Kubo I. i Matsumoto A., 1984], natomiast występując w postaci samego aglikonu albo w połączeniu aglikonu z kilkoma łańcuchami cukrowymi z grupą hydroksylową lub karboksylową (tzw. glikonem) tworzy saponiny triterpenowe (Ryc. 7.) [Liu J., 1995; Szakiel A. i wsp., 2002-2005; Chołuj A. i Janiszowska W., 2005], które dodatkowo chronią roślinę przed organizmami roślinożernymi [Szakiel A. i wsp., 2002-2005].
CZĘŚĆ TEORETYCZNA
34
Tabela 2. Naturalne źródła występowania kwasu oleanolowego (OA) [Li J., 2002; Chołuj A. i Janiszewska W., 2005]
ORGAN
GATUNEK
CZ
ĘŚĆ
NAD
ZIEM
NA
Liście
Acanthopanax nipponicus, Arctostaphylos uva-ursi, Beta vulgari, Calendula officinalis, Clematis montana, Coffea arabica , Crategus sp, Eucalyptus camaldulensis, Gymnema sylvestre, Hedera helix, Ilex paraguariensis, , Lavendula officinalis , Melissa officinalis , Nerium oleander, Ocimum basilicum , Olea europea , Origanum majorana, Origanum vulgare, Plantago major, Platanus acerifolia Polyscias fruticosa, Rosmarinum officinalis, Vaccinum myrtillus, Salvia officinalis, Sambucus nigra, Satureja montana,, Syzygium aromaticum, Thymus vulgaris, Thymus willdenowi, Viscum album
Kwiaty
Calendula officinalis, Helianthus annus, Sambucus nigraOwoce, skórka
Caesalpinia paraguariensis, Catunaregam nilotica, Hedera helix, Kochia scoparia, Olea europea, Phytolacca dodecandra, Prunus spinosa, Randia dumetorum, Sapindus emarginatusNasiona
Calendula cochinchinensis officinalis, Chenopodium quinoa, MomordicaKora, ziele
i inne
Anemone rivularis, Bassia muricata, Betula alba, Calendula arvensis, Calendula officinalis, Centaurium erythraea Chemaenerion angustifolium, Crategus sp., Euphorbia geniculata, Fagonia arabica, Glechoma hederacea, Hysopus officinalis, Lavendula officinalis, Leonurus cardiaca, Melissa officinalis, Melilutus officinalis, Olea europea, Origanum maiorana, Prunella vulgaris, Sambucus nigra, Syzygium aromaticum , Thymus vulgaris, Verbena officinalis
CZ
ĘŚĆ
P
O
D
ZIEM
NA
Bulwa
Ficaria ranunculoides, Leontice kiangnanensis, Talinum tenuissimumKorzeń
Aralia elata, Achyranthes faurei, Beta vulgaris, Calendula officinalis, Clematis chinensis, Clematis montana, Panax ginseng, Panax japonicus, Panax zigiberensis, Platycodon grandiflorum, Polyscias fruticosa, Pulsatilla patent, Viguiera decurrens
CZĘŚĆ TEORETYCZNA
35
Chemiczne pochodzenie i biosynteza kwasu oleanolowego oraz innych pochodnych triterpenoidowych wywodzi się z cząsteczki skwalenu, składającej się z sześciu reszt izoprenowych i będącego najbardziej znanym acyklicznym triterpenoidem, który po raz pierwszy został wyizolowany z tłuszczu wątroby rekina. Jego szerokie rozpowszechnienie zarówno w świecie zwierzęcym jak i roślinnym, potwierdza jego istotną role w biosyntezie alkoholi triterpenowych i steroli [Wrzeciono U. i Zaprutko L., 2001; Kołodziejczyk A., 2003]. W biosyntezie pentacyklicznych pochodnych proces cyklizacji cząsteczki skwalenu lub jego pochodnej 2,3-epoksydowej prowadzi do powstania, poprzez czterocykliczny układ bakchranu, do pięciocyklicznego szkieletu lupanu, a następnie układu oleananu (Ryc. 7.) [Wrzeciono U. i Zaprutko L., 2001].Ryc. 7. Biosynteza kwasu oleanolowego [Opracowano na podstawie prac: Lee M.H. i wsp., 2004]
CZĘŚĆ TEORETYCZNA
36
Podobieństwo triterpenów pentacyklicznych do steroidów opiera się przede wszystkim na występującym w obu grupach układu cykloheptano-perhydrofenantrenowego, tworzonego przez pięć skondensowanych pierścieni, z których cztery są zawsze sześcioczłonowe (A, B, C i D) a piąty (E) jest pięcio- lub sześcioczłonowy (Ryc. 8.). Ze względu na różne położenie grup metylowych w pierścieniach wyróżniono wiele typów triterpenów pięciocyklicznych, z których największe znaczenie farmakologiczne posiadają związki klasyfikujące się do typu lupanu, oleananu i ursanu [Wrzeciono U i Zaprutko L., 2001; Chołuj A. i Janiszowska W., 2005; Kujawa-Warchala K. i Nazaruk J., 2012].Ryc. 8. Budowa kwasu oleanolowego i strategiczne miejsca wpływające na aktywność przeciwbólową oraz przeciwzapalną: grupa hydroksylowa przy węglu C3
oraz grupa karboksylowa przy C17 [Opracowano na podstawie pracy Bednarczyk-Cwynar B. i wsp., 2012]
Występujące naturalnie saponiny triterpenowe, będące połączeniem cząsteczki kwasu oleanolowego z łańcuchem cukrowym przy C3 i/lub C17 podane drogą doustną są
niewrażliwe na system enzymów trawiennych w przewodzie pokarmowym, rozkładane są dopiero w jelicie grubym w obecności flory bakteryjne [Kida H. i wsp., 1998] (Ryc. 9). W ten sposób uwalniają się z nich triterpeny, które następnie ulegają resorpcji i integracji z błonami komórkowymi, dzięki temu mogą działać modulująco na mechanizmy przekazywania sygnału do komórki [Hasegawa H., 2004]. Wolny kwas oleanolowy zidentyfikowano w wielu ekstraktach roślinnych, natomiast zaznaczyć należy, że wyciągi
CZĘŚĆ TEORETYCZNA
37
roślinne bardzo często zawierają inne, nieglikozydowe pochodne kwasu oleanolowego, których aktywność biologiczna jest różna i najczęściej zależna od struktury chemicznej [Sakai K. i Fukuda Y., 2004-2006].Ryc.9. Struktura chemiczna 3-O-β-D-glukuronidu kwasu oleanolowego
Uważa się, że istotną rolę w aktywności przeciwbólowej oraz przeciwzapalnej pochodnych kwasu oleanolowego posiadają dwie grupy funkcyjne: grupa hydroksylowa – OH przy węglu C3 oraz karboksylowa –COOH przy węglu C17. Modyfikacja cząsteczki
triterpenu w kierunku zacetylowania grupy hydroksylowej przy C3 prowadziła do
znaczącego wzrostu aktywności przeciwbólowej u testowanych zwierząt, w zależności od długości wprowadzanego do cząsteczki łańcucha [Recio M.C. i wsp., 1995; Soldi C. i wsp., 2008; Bednarczyk-Cwynar B.i wsp., 2012]. Ostatecznie wykazano jednak, iż najsilniej działające pochodne w kierunku działania analgetycznego w swojej strukturze posiadają grupę hydroksyiminową [Paszel A. i wsp., 2008]. Ponadto przyjmuję się, iż modyfikacje w obrębie grupy karboksylowej przy C17 mogą wpływać na siłę działania związku
[Bednarczyk-Cwynar B. i wsp., 2012] (Ryc. 8).
Przez długi czas uważano, że kwas oleanolowy jest biologicznie nieaktywny. Pojawiające się pierwsze doniesienia o pożądanych właściwościach farmakologicznych połączonych z relatywnie niską toksycznością, wywodzących się najczęściej z medycyny i kultury azjatyckiej, zainteresowały wiele ośrodków badawczych na całym świecie