Chemia Ogólna
KOROZJA
Korozja – osłabienie podstawowych własności
materiału w wyniku reakcji z otoczeniem.
• korozja ogólna,
• korozja lokalna: wżerowa, szczelinowa, międzykrystaliczna, • korozja naprężeniowa, • procesy korozyjno–erozyjne, • kawitacja, • korozja atmosferyczna, • korozja w betonie, • korozja w glebie, • korozja biologiczna, • korozja wysokotemperaturowa.
Rodzaje korozji
Środowiska korozyjne
• kwaśne, • alkaliczne, • woda morska, • solanka, • środowiska organiczne, • stopione sole.Korozja elektrochemiczna
Korozja elektrochemiczna (glawaniczna) –
najczęściej występujący typ korozji. Zachodzi
podczas zetknięcia dwóch metali o różnych
potencjałach
elektrochemicznych.
Tworzą
one
ogniwo galwaniczne, gdzie metal o niższym
potencjale stanowi anodę, zaś metal o wyższym
potencjale – katodę.
ne
Me
Me
n
d
Re
ne
Ox
Mechanizm korozji elektrochemicznej
Zniszczenie metalu następuje w wyniku reakcji
anodowej:
Typowe reakcje katodowe (redukcji):
2H
2
1
e
H
2
H
O
4
e
4
OH
O
2 2
2 3e
Fe
Fe
e
Cu
Cu
2Ogniwa galwaniczne
Rodzaj procesu korozyjnego związany jest z:
• występowaniem naprężeń,
• obecnością wtrąceń,
Schemat ogniwa korozyjnego: a) stal węglowa pokryta miedzią, b) stal węglowa pokryta cynkiem.
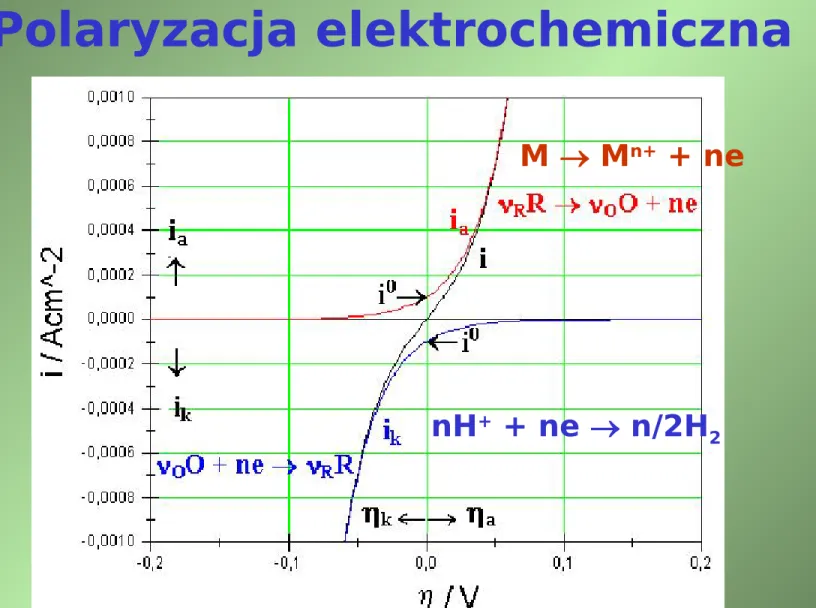
Polaryzacja elektrochemiczna
Diagram polaryzacyjny dla reakcji: OO + ne RR
nH+ + ne n/2H 2
Pasywacja
Pasywacja – stan odporności korozyjnej aktywnego
metalu w wyniku utworzenia odpornej warstwy
powierzchniowej inhibitującej proces korozji w
określonym środowisku i określonych warunkach pH.
H O Me(H O) MeOH H e Me 2 2 ad ad H e ) OH ( Me 2 O H MeO 2 O H2 e MeOH O H Me2 2 H
rozpuszczanie
pasywacja
Możliwe ścieżki reakcji metalu w wodzie.Mechanizm pasywacji
Źródłem tlenu, niezbędnego dla powstania warstwy pasywnej, mogą być:
- w środowisku wodnym: • cząsteczki wody,
• rozpuszczony tlen.
- w środowiskach bezwodnych:
• cząsteczki kwasów tlenowych (H2SO4, H3PO4, HNO3, HCOOH), • aniony zawierające tlen (CrO4-2, Cr
2O7-2, MnO4-),
2 O
p
3 corr p 3 ki
U
U
i
Odporność korozyjna stopów zależy od obecności i ilości składników stopowych posiadających wysokie powinowactwo do tlenu i zdolności tworzenia warstwy pasywnej. Najważniejszym pierwiastkiem stopowym odpowiedzialnym za pasywację jest chrom.
Wpływ składników stopowych na kształt
Korozja wżerowa
Korozja wżerowa – rodzaj korozji lokalnej w wyniku której
powstają „dziury” w materiale.
Jest bardziej niebezpieczna od korozji ogólnej, ponieważ trudniej ją przewidzieć i jej przeciwdziałać. Występuje na metalach i stopach ulegających pasywacji.
Korozja międzykrystaliczna
Korozja międzykrystaliczna – korozja zachodzą wzdłuż granic ziaren metalu osłabiająca znacząco właściwości
mechaniczne stopu. Korozja międzykrystaliczna stali
chromowych jest związana ze zjawiskiem wydzielania się węglików chromu na granicach ziaren i ze zubożeniem przygranicznych obszarów ziaren w chrom.
Korozja międzykrystaliczna części samolotu wykonana ze stopu aluminum 7075-T6
Korozja naprężeniowa
Korozja naprężeniowa – pęknięcia materiału
spowodowane naprężeniami oraz środowiskiem korozyjnym.
Korozja naprężeniowa wymiennika cieplnego ze stopu Inconel z pęknięciami wzdłuż granic ziaren.
Ochrona przed korozją
•
stopy odporne na korozję,
•
kompozyty,
•
powłoki ochronne,
•
ochrona katodowa,
•
ochrona anodowa,
•
inhibitory.
Powłoki ochronne metaliczne
0 nne
M
M
Zn
2++ 2e Zn
0Cu
2++ 2e Cu
0Ni
2++ 2e Ni
0Cr
3++ 3e Cr
0Ag
++ e Ag
0Au
3++ 3e Au
0Przykłady:
Powłoki ochronne organiczne
D r y in g o ils B it u m e n s F o s s il r e s in s L o w - m o le c u la r C e lu lo s e d e r iv a t iv e s N a t u r a l r u b b e r C a s e in H ig h - m o le c u la r N a t u r a l A lk y d r e s in s P o ly e s t e r s E p o x y r e s in s P h e n o lic r e s in s A m in o r e s in s P o ly a m id e s P o ly u r e t h a n s S ilic o n s C o n d e n s a t io n a n d a d d it io n o lig o m e r s R u b b e r P o ly o le f in P o ly v in y l c h lo r id e P o ly v in y l a c e t a t e s P o ly a c r y ls A d d it io n p o ly m e r s S y n t h e t ic F ilm f o r m in g s u b s t a n c e s o r ig in f r o mOchrona katodowa
Chroniony metal jest katodą – pokrywa się go metalem o niższym potencjale (protektor), bądź podnosi się jego potencjał poprzez zewnętrzne źródło zasilania.
a) inhibitory anodowe, np. fosforany, krzemiany); b) inhibitory katodowe, np. Ca(HCO3)2, polifosforany,;
c) inhibitory anodowo–katodowe, np. aminy.