1
1
Elektrochemia
Elektrochemia
Jak pozyska
Jak pozyska
ć
ć
energi
energi
ę
ę
z reakcji
z reakcji
redoksowych?
2
2
Ogniwo galwaniczne to urządzenie, w którym wytwarzany jest
prąd elektryczny – strumień elektronów w przewodniku – dzięki
przebiegowi samorzutnej reakcji chemicznej.
Składa się z dwóch elektrod, czyli metalicznych przewodników,
które pozostają w kontakcie z elektrolitem, czyli przewodnikiem
jonowym.
Ogniwa galwaniczne
3
3
Ogniwa galwaniczne
Ogniwa galwaniczne
reakcja ca
reakcja ca
ł
ł
kowita
kowita
8H
8H
+
+
+ MnO
+ MnO
4
4
−
−
+ 5Fe
+ 5Fe
2+
2+
→
→
Mn
Mn
2+
2+
+ 5Fe
+ 5Fe
3+
3+
+ 4H
+ 4H
2
2
O
O
redukcja:
redukcja:
8H
8H
+
+
+ MnO
+ MnO
4
4
−
−
+ 5e
+ 5e
−
−
→
→
Mn
Mn
2+
2+
+ 4H
+ 4H
2
2
O
O
utlenianie:
utlenianie:
5Fe
5Fe
2+
2+
→
→
5Fe
5Fe
3+
3+
+ 5e
+ 5e
−
−
4 4
Ogniwa galwaniczne
Ogniwa galwaniczne
MnO
MnO
4
4
−
−
Η
Η
+
+
Fe
Fe
2+
2+
KMnO
KMnO
4
4
H
H
2
2
SO
SO
4
4
FeSO
FeSO
4
4
redukcja
redukcja
utlenianie
utlenianie
(-)
(+)
e
5 5
Ogniwa galwaniczne
Ogniwa galwaniczne
MnO
MnO
4
4
−
−
Η
Η
+
+
Fe
Fe
2+
2+
KMnO
KMnO
4
4
H
H
2
2
SO
SO
4
4
FeSO
FeSO
4
4
redukcja
redukcja
utlenianie
utlenianie
(-)
(+)
e
aniony
Jak zbudować ogniwo?
6
6
Ogniwa galwaniczne
Ogniwa galwaniczne
Co to jest siła elektromotoryczna ogniwa (SEM)?
katodakatoda
anoda
anoda
elektrony
utlenianie
utlenianie
redukcja
redukcja
Siła elektromotoryczna
ogniwa (napięcie ogniwa),
SEM, jest miarą zdolności reakcji
ogniwa do spowodowania przepływu
elektronów przez obwód
7 7
Ogniwa galwaniczne
Ogniwa galwaniczne
redukcja:
redukcja:
Cu
Cu
2+
2+
+ 2e
+ 2e
−
−
→
→
Cu
Cu
utlenianie:
utlenianie:
Zn
Zn
→
→
Zn
Zn
2+
2+
+ 2e
+ 2e
−
−
Cu
Cu
2+
2+
+ Zn →
+ Zn
→
Cu + Zn
Cu + Zn
2+
2+
Elektrochemia_ogniwo.MOV
Oznaczenia
Zn(s)|Zn
2+
(aq) oraz Cu
2+
(aq)| Cu(s)
substrat
produkt
zetknięcie
faz
Zn(s)|Zn
2+
(aq)
||
Cu
2+
(aq)|Cu(s)
ogniwo Daniella
8 8
Ogniwa galwaniczne
Ogniwa galwaniczne
redukcja:
redukcja:
Cu
Cu
2+
2+
+ 2e
+ 2e
−
−
→
→
Cu
Cu
utlenianie:
utlenianie:
Zn
Zn
→
→
Zn
Zn
2+
2+
+ 2e
+ 2e
−
−
Cu
Cu
2+
2+
+ Zn
+ Zn
→
→
Cu + Zn
Cu + Zn
2+
2+
Jak zmierzyć napięcie ogniwa?
Zn
Zn
Zn
Cu
Cu
Cu
ZnSO
4ZnSO
ZnSO
44CuSO
CuSO
CuSO
444utlenianie
utlenianie
redukcja
redukcja
17_363 e– e – e– e– Zn2+ SO4 2– Zn( s) 1.0 M Zn2+ Anoda 1.0 M Cu 2+ Katoda Cu2+ SO4 2– Cu( s)zmierzone SEM= 1.10 V
9 9
Ogniwa galwaniczne
Ogniwa galwaniczne
redukcja:
redukcja:
Cu
Cu
2+
2+
+ 2e
+ 2e
−
−
→
→
Cu
Cu
utlenianie:
utlenianie:
Zn
Zn
→
→
Zn
Zn
2+
2+
+ 2e
+ 2e
−
−
Jak obliczyć napięcie ogniwa?
potencjały standardowe półogniw
elektroda wodorowa
10
10
H
+
(aq)|H
2
(g)|Pt(s)
Jeśli działa jako katoda –
redukują się jony H
+
Pt (s)|H
2
(g)|H
+
(aq)
Ogniwa galwaniczne
Ogniwa galwaniczne
elektroda wodorowa
Jeśli działa jako anoda –
H
2
zostaje utlenione
1 mol/dm
3
HCl
H
+
p
H2
= 1013 hPa
E
H2
= O V
Jak obliczyć napięcie ogniwa?
11 11
Ogniwa galwaniczne
Ogniwa galwaniczne
utlenianie:
utlenianie:
Zn
Zn
→
→
Zn
Zn
2+
2+
+ 2e
+ 2e
−
−
Jak obliczyć napięcie ogniwa?
potencjały standardowe półogniw
17_363 e– e – e– e– Zn2+ SO4 2– Zn( s) 1.0 M Anoda 1.0 M Katoda H+ Cl -Pt s)
H
20.76
redukcja:
redukcja:
2
H
H
+
+
+ 2e
+ 2e
−
−
→
→
H
H
2
2
2
H
H
+
+
+ Zn →
+ Zn
→
H
H
2
2
+ Zn
+ Zn
2+
2+
V
V
V
E
E
E
SEM
o
o
o
Zn Zn H H76
.
0
0
76
.
0
2 2+
=
+
=
∆
=
+ → → +12
12
Ogniwa galwaniczne
Ogniwa galwaniczne
Jak obliczyć napięcie ogniwa?
potencjały standardowe półogniw
17_363 e– e – e– e–
Anoda
1.0 M Katoda H+ Cl -Pt sH
20.34
utlenianie:
utlenianie:
H
2
→
→
2H
2H
+
+
+ 2e
+ 2e
H
2
+ Cu
+ Cu
2+
2+
→
→
2H
2H
+
+
+ Cu
+ Cu
V
V
V
E
E
E
SEM
o
o
o
H H Cu Cu0
34
.
0
34
.
0
2 2+
=
+
=
∆
=
+ → → + Cu (s) Cu2+ SO4 2-1.0 Mredukcja:
redukcja:
Cu
Cu
2+
2+
+ 2e
+ 2e
−
−
→
→
Cu
Cu
13 13
Ogniwa galwaniczne
Ogniwa galwaniczne
Zn
Zn
Zn
Cu
Cu
Cu
ZnSO
4ZnSO
ZnSO
44CuSO
CuSO
CuSO
444utlenianie
utlenianie
redukcja
redukcja
17_363 e– e – e– e– Zn2+ SO4 2– Zn( s) 1.0 M Zn2+ Anoda 1.0 M Cu 2+ Katoda Cu2+ SO4 2– Cu( s)V
V
V
E
E
E
SEM
o
o
o
Zn Zn Cu Cu76
.
0
34
.
0
10
.
1
2 2+
=
+
=
∆
=
+ → → +redukcja:
redukcja:
Cu
Cu
2+
2+
+ 2e
+ 2e
−
−
→
→
Cu
Cu
utlenianie:
utlenianie:
Zn
Zn
→
→
Zn
Zn
2+
2+
+ 2e
+ 2e
−
−
Cu
Cu
2+
2+
+ Zn
+ Zn
→
→
Cu + Zn
Cu + Zn
2+
2+
Jak obliczyć napięcie ogniwa?
potencjały standardowe półogniw
14
14
Ogniwa galwaniczne
Ogniwa galwaniczne
potencja
potencja
ł
ł
y standardowe
y standardowe
0 .5 4 L i+ + e− → Li −3.0 5
1 7 _ 0 1 T
T a b le 1 7 .1
S ta n d a rd R e d u ctio n P o te n tia ls a t 2 5 °C (2 9 8 K ) fo r M a n y
C o m m o n H a lf-re a ctio n s
H a lf-re a c tio n
ξ ° (V )
H a lf-re a ctio n
2 .8 7 O2 + 2 H2O + 4e− → 4H O− 0 .4 0 1 .9 9 C u2 + + 2 e− → C u 0 .3 4 1 .8 2 H g2C l2 + 2 e− → 2H g + 2C l− 0 .3 4 1 .7 8 A g C l + e− → A g + C l− 0 .2 2 1 .7 0 S O42− + 4 H+ + 2e− → H2S O3 + H2S O3 + H2O 0 .2 0 1 .6 9 C u2 + + e− → C u+ 0 .1 6 1 .6 8 2 H+ + 2 e− → H 2 0 .0 0 1 .6 0 F e3 + + 3 e− → F e −0.0 36 1 .5 1 P b2 + + 2 e− → P b −0.1 3 1 .5 0 S n2 + + 2 e− → S n −0.1 4 1 .4 6 N i2 + + 2 e− → N i −0.2 3 1 .3 6 P b S O4 + 2 e− → P b + S O42− −0.3 5 1 .3 3 C d2 + + 2 e− → C d −0.4 0 1 .2 3 F e2 + + 2 e− → F e −0.4 4 1 .2 1 C r3 + + e− → C r2+ −0.5 0 1 .2 0 C r3 + + 3 e− → C r −0.7 3 1 .0 9 Z n2 + + 2 e− → Z n −0.7 6 1 .0 0 2 H2O + 2 e− → H 2 + 2 O H− −0.8 3 0 .9 9 M n2+ + 2 e−→ M n −1.1 8 0 .9 6 A l3 + + 3 e− → A l −1.6 6 0 .9 5 4 H2 + 2 e− → 2H− −2.2 3 0 .9 1 M g2+ + 2 e−→ M g −2.3 7 0 .8 0 L a3 + + 3 e− → La −2.3 7 0 .8 0 N a+ + e− → N a −2.7 1 0 .7 7 C a2 + + 2 e− → C a −2.7 6 0 .6 8 B a2 + + 2 e− → B a −2.9 0 I2 + 2 e− → 2I− F2 + 2 e− → 2F− A g2 + + e− → A g+ C o3 + + e− → C o2 + H2O2 + 2 H+ + 2 e− → 2H2O C e4 + + e− → C e3 + P b O2 + 4 H+ + S O42− + 2 e−→ P bS O4 + 2 H2O M n O4− + 4 H+ + 3 e−→ M n O 2 + 2 H2O 2 e− + 2 H+ + IO 4−→ IO3− + H2O M n O4− + 8 H+ + 5 e−→ M n2 + + 4 H2O A u3 + + 3 e− → A u P b O2 + 4 H+ + 2 e−→ P b2 + + 2 H 2O C l2 + 2 e− → 2C l− C r2O72− + 1 4 H+ + 6 e−→ 2C r3 + + 7 H2O O2 + 4 H+ + 4 e− → 2H2O M n O2 + 4 H+ + 2 e−→ M n2 + + 2 H2O IO3− + 6 H+ + 5 e−→ ½ I2 + 3 H2O B r2 + 2 e− → 2B r− V O2 + 2 H+ + e− → V O2 + + H 2O A u C l4− + 3 e− → A u + 4C l− N O3− + 4 H+ +3 e− → N O + 2H2O C lO2 + e− → C lO2− 2 H g2 + + 2 e− → H g 22 + A g+ + e− → A g H g22 + + 2 e− → 2H g+ F e3 + + e− → F e2+ O2 + 2 H+ + 2 e− → H2O2 M n O4− + e−→ M n O42− 0 .5 6 K+ + e− → K −2.9 2 0 .5 2 C u+ + e− → C u
ξ ° (V )
15
15
Ogniwa galwaniczne
Ogniwa galwaniczne
Jak obliczyć napięcie ogniwa?
potencjały standardowe półogniw
jedna z reakcji musi być odwrócona – zmiana znaku E
o
bilans elektronów nie zmienia wartości E
o
SEM>0
E
Ө
> 0 metal szlachetny
E
Ө
< 0 metal zwykły
16
16
Ogniwa galwaniczne
Ogniwa galwaniczne
Jak obliczyć napięcie ogniwa?
Przykład 1
Ogniwo galwaniczne jest oparte na następującej reakcji:
Al
3+
(aq) + Mg(s) → Al(s) + Mg
2+
(aq)
Podaj zbilansowane równanie reakcji połówkowych w ogniwie oraz oblicz
potencjał standardowy ogniwa (SEM).
Z szeregu napięciowego (dla reakcji redukcji):
Al
3+
+ 3e → Al E
o
= -1.66V
Mg
2+
+ 2e → Mg
E
o
= -2.37V
redukcja: 2Al
3+
+ 6e → 2Al E
o
= -1.66V katoda
utlenianie: 3Mg → 3Mg
2+
+ 6e
E
o
= 2.37V anoda
17
17
Samorzutno
Samorzutno
ść
ść
reakcji redoksowej
reakcji redoksowej
termodynamika w ogniwach
termodynamika w ogniwach
zmiana konwencji
zmiana konwencji
⎥⎦
⎥
⎢⎣
⎢
−
=
∆
=
C
J
q
W
E
SEM
E – potencjał półogniwa, V
W – praca, J
Q – całkowity ładunek elektronów, C
max
E
q
W
=
−
⋅
∆
18
18
Samorzutno
Samorzutno
ść
ść
reakcji redoksowej
reakcji redoksowej
termodynamika w ogniwach
termodynamika w ogniwach
zmiana konwencji
zmiana konwencji
n – liczba moli elektronów, mol
q –całkowity ładunek elektronów, C
F – stała Faradaya, C/mol
ładunek mola
elektronów
mol
C
F
=
96485
max
max
q
E
W
=
−
⋅
∆
F
n
q
=
⋅
19
19
Samorzutno
Samorzutno
ść
ść
reakcji redoksowej
reakcji redoksowej
termodynamika w ogniwach
termodynamika w ogniwach
zmiana konwencji
zmiana konwencji
0
0
0
⇒
∆
max
>
⇒
>
<
∆
G
E
SEM
G
W
max
=
∆
max
E
nF
G
=
−
∆
∆
20
20
Samorzutno
Samorzutno
ść
ść
reakcji redoksowej
reakcji redoksowej
r
r
ó
ó
wnanie Nernsta
wnanie Nernsta
Q – równoważnik reakcji
aA + bB
aA + bB
→
→
cC + dD
cC + dD
d
c
b
a
D
C
B
A
Q
0
0
0
0
]
[
]
[
]
[
]
[
=
Q
nF
RT
E
E
=
∆
o
−
ln
∆
Jak obliczyć napięcie ogniwa?
max
E
nF
G
=
−
∆
∆
Q
RT
G
G
=
∆
o
+
ln
∆
21
21
Samorzutno
Samorzutno
ść
ść
reakcji redoksowej
reakcji redoksowej
Przyk
Przyk
ł
ł
ad 4
ad 4
Czy reakcja:
Cu
2+
(aq) + Fe(s) →Cu(s) + Fe
2+
(aq)
jest samorzutna?
redukcja:
redukcja:
Cu
Cu
2+
2+
+ 2e
+ 2e
−
−
→
→
Cu
Cu
E
E
o
o
= 0.34 V
= 0.34 V
utlenianie:
utlenianie:
Fe
Fe
→
→
Fe
Fe
2+
2+
+ 2e
+ 2e
−
−
E
E
o
o
= 0.44 V
= 0.44 V
0
10
5
.
1
78
.
0
96458
2
78
.
0
96458
2
78
.
0
5
<
⋅
−
=
=
⋅
−
=
=
⋅
−
=
∆
∆
−
=
∆
=
∆
J
C
J
mol
C
mol
V
mol
C
mol
G
E
nF
G
V
E
o
o
o
o
Zauwa
Zauwa
ż
ż
my,
my,
ż
ż
e z szeregu napi
e z szeregu napi
ę
ę
ciowego dla
ciowego dla
reakcji redukcji:
reakcji redukcji:
Fe
Fe
2+2++ 2e
+ 2e
--→
→
Fe
Fe
E
E
oo=
=
-
-
0.44 V
0.44 V
zm
ian
a z
na
ku
22
22
Samorzutno
Samorzutno
ść
ść
reakcji redoksowej
reakcji redoksowej
Przyk
Przyk
ł
ł
ad 5
ad 5
Czy HNO
3
rozpuści złoto?
redukcja:
redukcja:
NO
NO
3
3
-
-
+ 4H
+ 4H
+
+
+ 3e
+ 3e
-
-
→
→
ΝΟ + 2Η
ΝΟ + 2Η
2
2
Ο
Ο
E
E
o
o
=0.96 V
=0.96 V
utlenianie:
utlenianie:
Au
Au
→
→
Au
Au
3+
3+
+ 3e
+ 3e
−
−
E
E
o
o
=
=
-
-
1.50V
1.50V
0
0
54
.
0
>
∆
⇒
<
∆
−
=
∆
o
o
o
G
E
V
E
23
23
Samorzutno
Samorzutno
ść
ść
reakcji redoksowej
reakcji redoksowej
Przyk
Przyk
ł
ł
ad 6
ad 6
Oblicz SEM ogniwa na
podstawie wartości
potencjałów półogniw z
szeregu napięciowego:
T=25
o
C
[VO
2
+
]=2.0 M
[H
3
O
+
]=0.50 M
[VO
2+
]=0.010 M
[Zn
2+
]=0.10 M
VO
2
+
+ 2H
+
+ e
-
→ VO
2+
+ H
2
O
E
E
o
o
= 1.00 V
= 1.00 V
Zn
Zn
2+
2+
+ 2e
+ 2e
→
Zn
Zn
E
E
o
o
=
=
-
-
0.76V
0.76V
dla
dla
24
24
Samorzutno
Samorzutno
ść
ść
reakcji redoksowej
reakcji redoksowej
Przyk
Przyk
ł
ł
ad 6
ad 6
V
E
o
=
1
.
76
∆
2VO
2
+
+ 4H
+
+ 2e
-
→ 2VO
2+
+ 2H
2
O
E
E
o
o
= 1.00 V
= 1.00 V
Zn
Zn
→
Zn
Zn
2+
2+
+ 2e
+ 2e
-
-
E
E
o
o
= 0.76V
= 0.76V
V
V
V
V
VO
O
H
VO
Zn
mol
C
mol
K
K
mol
J
V
E
89
.
1
13
.
0
76
.
1
2
)
5
.
0
(
)
01
.
0
(
1
.
0
ln
01283
.
0
76
.
1
]
[
]
[
]
][
[
ln
96485
2
298
31
.
8
76
.
1
2
4
2
2
2
4
3
2
2
2=
=
+
=
⋅
−
=
=
⋅
⋅
−
=
∆
+
+
+ +2VO
2
+
+ 4H
+
+
Zn
Zn
→ 2VO
2+
+ Zn
2+
+ 2H
2
O
25
25
Akumulator kwasowy (ołowiowy) - stosowany w
samochodach; regenerowalne (ogniwo wtórne)
Pb(s)|PbSO
4
(s)|H
+
(aq),HSO
4
-
(aq)|PbO
2
(s)|PbSO
4
(s)|Pb(s), 2 V
płyta oddzielająca płyta anody płyta katodyOgniwa galwaniczne
Ogniwa galwaniczne
A, utlenianie: Pb + HSO
4
-
→ PbSO
4
+ H
+
+ 2e
-K, redukcja: PbO
K, redukcja: PbO
2
2
+ H
+ H
2 SO4
2 SO4
+ 2e
+ 2e
-
-
→ PbSO
26
26
Ogniwo suche - nie można ponownie ładować;
gdy reakcja ogniwa osiągnie stan równowagi,
ogniwo nadaje się do wyrzucenia (ogniwo pierwotne).
Zn(s)|ZnCl
2
(aq), NH
4
Cl(aq)|MnO(OH)(s)|MnO
2
(s)|grafit, 1,5 V
naczynie cynkowe (anoda) MnO2+ grafit +NH4Cl pręt grafitowy (katoda)
Ogniwa galwaniczne
Ogniwa galwaniczne
A, utlenianie:
Zn →
Zn
Zn
Zn
2+
2+
+ 2e
+ 2e
-
-K, redukcja: 2NH
K, redukcja: 2NH
4
4
+ 2MnO
+ 2MnO
2
2
+ 2 e
+ 2 e
-
-
→ Mn
2
O
3
+ 2NH
+ 2NH
3
3
+ H
+ H
2
2
O
O
A, utlenianie:
Zn + 2OH
Zn + 2OH
-
-
→
ZnO + H
ZnO + H
2
2
O + 2e
O + 2e
-
-K, redukcja: 2MnO
K, redukcja: 2MnO
2
2
+ H
+ H
2
2
O + 2e
O + 2e
-
-
→ Mn
2
O
3
+ 2OH
+ 2OH
-
27
27
Akumulator niklowo-kadmowy –
stosowany do zasilania urządzeń elektronicznych.
Cd(s)|Cd(OH)
2
(s)|KOH(aq) |Ni(OH)
3
(s)|Ni(OH)
2
(s)|Ni(s), 1,25 V
płyta oddzielająca płyta dodatnia
płyta ujemna
Ogniwa galwaniczne
Ogniwa galwaniczne
A, utlenianie:
Cd + 2OH
Cd + 2OH
-
-
→
Cd(OH)
Cd(OH)
2
2
+ 2e
+ 2e
-
-K, redukcja: NiO
K, redukcja: NiO
2
2
+ 2H
+ 2H
2
2
O
O
+ 2 e
+ 2 e
-
-
→ Ni(OH)
-28
28
2H
2H
2
2
(
(
g
g
) + O
) + O
2
2
(
(
g
g
)
)
→
→
2H
2H
2
2
O(
O(
l
l
)
)
anoda
anoda
: 2H
: 2H
2
2
+ 4OH
+ 4OH
−
−
→
→
4H
4H
2
2
O + 4e
O + 4e
−
−
katoda
katoda
: 4e
: 4e
−
−
+ O
+ O
2
2
+ 2H
+ 2H
2
2
O
O
→
→
4OH
4OH
−
−
Ogniwa galwaniczne
Ogniwa galwaniczne
Ogniwo paliwowe
Wykorzystanie ogniw paliwowych na skalę
technologiczną zależy od wynalezienia taniej metody
otrzymywania wodoru
29
29
Stabilno
Stabilno
ść
ść
stopni
stopni
utlenienia
30
30
Diagram FROST EBSWORTH
Diagram FROST EBSWORTH
Stabilno
Stabilno
ść
ść
stopni
stopni
utlenienia
utlenienia
+5,18 +499,8
+5,18 +499,8
Mn
Mn
Mn
Mn
2+
2+
Mn
Mn
3+
3+
MnO
MnO
2
2
MnO
MnO
4
4
2
2
-
-MnO
MnO
4
4
-
--
2,36
2,36
-
-
227,7
227,7
--
0,85
0,85
-
-
85,0
85,0
+0,1 +9,7
+0,1 +9,7
+4,62 +445,8
+4,62 +445,8
+5,18 +499,8
+5,18 +499,8
Mn
Mn
Mn
Mn
2+
2+
Mn
Mn
3+
3+
MnO
MnO
2
2
MnO
MnO
4
4
2
2
-
-MnO
MnO
4
4
-
--
2,36
2,36
-
-
227,7
227,7
--
0,85
0,85
-
-
85,0
85,0
+0,1 +9,7
+0,1 +9,7
+4,62 +445,8
+4,62 +445,8
1. Stabilność
2. Dysproporcjonacja
3. Utleniacze i reduktory
4. Ograniczenie kinetyczne
5. Warunki standardowe
31
31
Stabilno
Stabilno
ść
ść
stopni
stopni
utlenienia
utlenienia
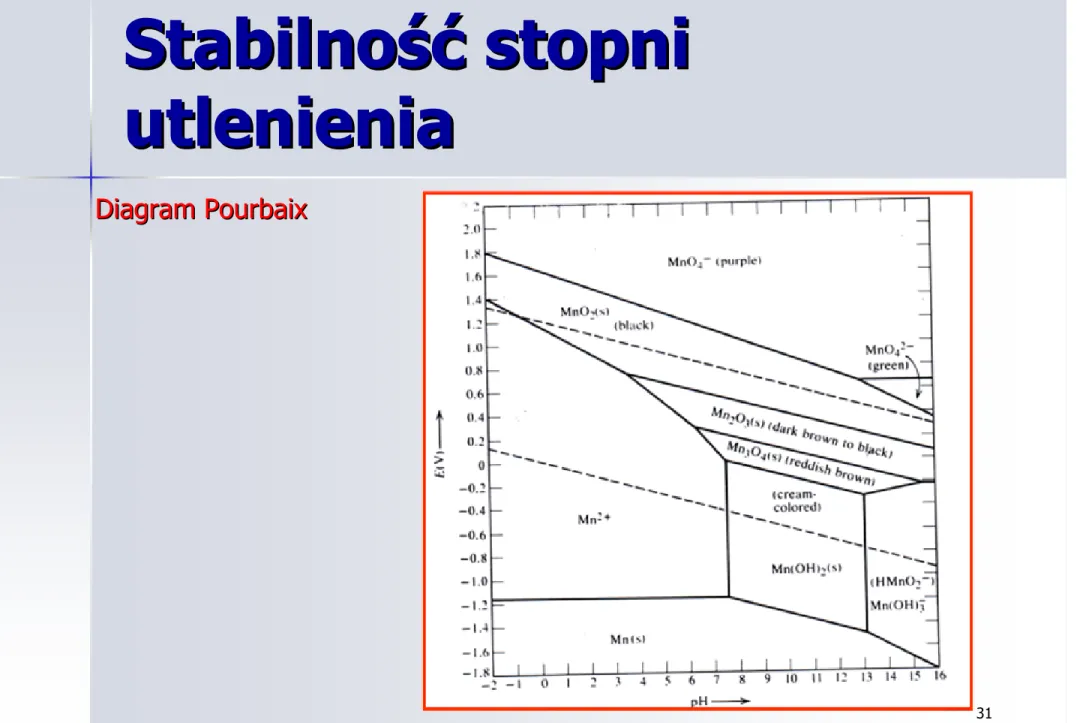
Diagram Pourbaix
32
32