Aleksandra Klimowicz
Rekombinowana ludzka tyreotropina w diagnostyce
i terapii zróżnicowanego raka tarczycy.
Rozprawa doktorska
Promotor:
Dr hab. med. Maria Gryczyńska Prof. UM
Katedra i Klinika Endokrynologii, Przemiany Materii
i Chorób Wewnętrznych
Uniwersytet Medyczny im. Karola Marcinkowskiego w Poznaniu
2 Podziękowania
Promotorowi – Pani Prof. UM dr hab. med. Marii Gryczyńskiej za życzliwość, wsparcie, za pomoc merytoryczną i poświęcony czas
Panu Prof. dr hab. med. Markowi Ruchale Kierownikowi Katedry i Kliniki Endokrynologii, Przemiany Materii i Chorób Wewnętrznych za umożliwienie realizacji pracy, przychylność oraz bezcenne wskazówki
Panu Prof. dr hab. med. Jerzemu Sowińskiemu poprzedniemu Kierownikowi Katedry i Kliniki Endokrynologii, Przemiany Materii
i Chorób Wewnętrznych za zgodę na realizację niniejszej pracy oraz okazywaną życzliwość
Pracownikom Katedry i Kliniki Endokrynologii, Przemiany Materii i Chorób Wewnętrznych za otwartość, współpracę i pomoc w realizacji pracy
Składam podziękowania moim Rodzicom i Córce za okazaną cierpliwość i wsparcie
3
SPIS TREŚCI
1. WYKAZ SKRÓTÓW ... 5
2. WSTĘP ... 7
2.1. Zróżnicowany rak tarczycy ... 7
2.1.1. Rys historyczny ... 7
2.1.2. Epidemiologia raka tarczycy ... 11
2.1.3. Czynniki ryzyka i ocena rokowania ... 13
2.1.4. Charakterystyka zróżnicowanego raka tarczycy ... 15
2.1.4.1. Rak brodawkowaty tarczycy ... 15
2.1.4.2. Rak pęcherzykowy tarczycy ... 16
2.1.5. Objawy i diagnostyka ... 17
2.1.6. Leczenie i monitorowania ZRT ... 17
2.1.6.1. Leczenie operacyjne ... 17
2.1.6.2. Leczenie izotopem jodu 131I ... 20
2.1.6.3. Monitorowanie choroby ... 24
2.1.6.4. Leczenie zaawansowanego zróżnicowanego raka tarczycy ... 26
2.1.7. Hormon tyreotropowy ... 27
2.1.8. Ludzki rekombinowany hormon tyreotropowy ... 31
3. CEL PRACY ... 36
4. MATERIAŁ I METODY ... 37
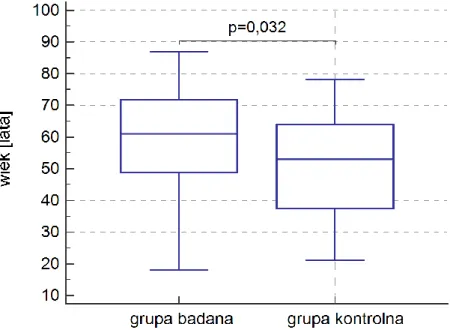
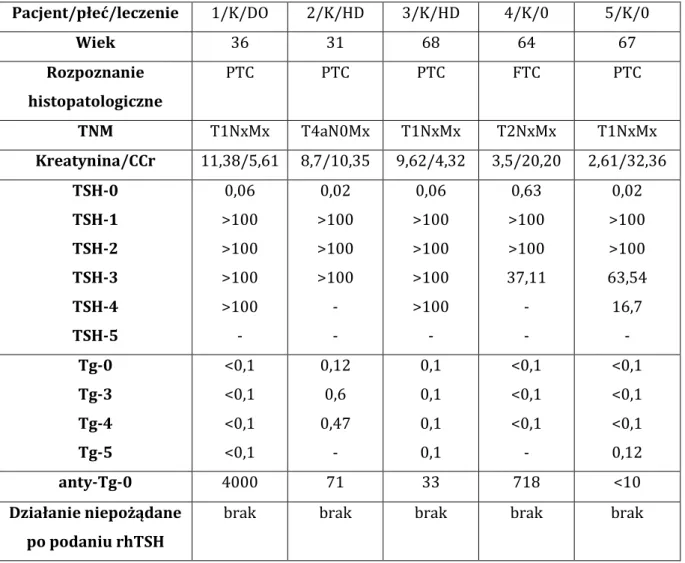
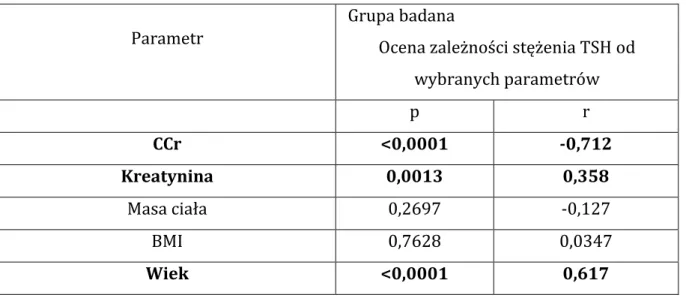
4.1. Charakterystyka badanej grupy ... 37
4.2. Stymulacja TSH ... 41
4.2.1. Stymulacja egzogennym TSH ... 41
4.2.2. Endogenna stymulacja TSH ... 43
4.3. Badania laboratoryjne oraz dodatkowe obliczenia ... 45
4.4. Scyntygrafia poterapeutyczna z zastosowaniem 131I ... 47
4.5. Obliczenia statystyczne ... 47
5. WYNIKI ... 48
6. OMÓWIENIE ... 73
7. WNIOSKI ... 95
4
9. SUMMARY ... 98 10. PIŚMIENNICTWO ... 100 11. SPIS RYCIN I TABEL ... 132
5
1. WYKAZ SKRÓTÓW
Anty-TPO - przeciwciała przeciwko peroksydazie tarczycowej ATC - rak anaplastyczny tarczycy (ang. anaplastic thyroid carcinoma) Anty-Tg - przeciwciała przeciwtyreoglobulinowe
BACC - biopsja aspiracyjna cienkoigłowa
BRAF- gen kodujący kinazę serynowo-treoninowa B-raf (BRAF – v-raf murine sarcoma
viral oncogene homolog B1)
cAMP - cykliczny adenozyno- monofosforan CHT - chemioterapia
DA - dopamina DIT - dijodotyrozyna
EMEA - Europejska Agencja Oceny Leków (ang. European Medicines Agency) FDA- Amerykańska Agencja do Spraw Żywności i Leków (ang. Food and Drug
Administration)
FSH - hormon folikulotropowy
FTC - rak pęcherzykowy tarczycy (ang. follicular thyroid carcinoma) HCC- nowotwór z komórek Hürthle’a (ang. Hürthle cell thyroid carcinoma) HCG - ludzka gonadotropina kosmówkowa (ang. human chorionic gonadotropin) Kb – tysiąc par zasad (ang. kilobase)
LH - hormon luteinizujący
MAPK – kinaza białkowa aktywowana przez mitogeny (ang. mitogen-activated protein
kinase)
Me - mediana
MET - protoonkogen kodujący białko receptora czynnika wzrostu hepatocytów
MIT - monojodotyrozyna
Na+/K+ ATP-aza - pompa sodowo-potasowa, ATP-aza sodowa-potasowa
NADPH - fosforan dinukleotydu nikotynamidoadeninowego
NIS - symporter sodowo-jodowy (ang. natrium iodide symporter)
NTRK1 - gen receptora o typie kinazy tyrozynowej dla neurotrofin (ang. neurotrophic
tropomyosin receptor kinase gene)
6
PDS - gen kodujący pendrynę (ang. pendred syndrome gene)
PPARγ - Receptor aktywowany proliferatorami peroksysomów (ang. peroxisome
proliferator-activated receptors)
PTC - rak brodawkowaty tarczycy (ang. papillary thyroid carcinoma)
RAS - gen kodujący białko o charakterze GTPazy
RET - gen kodujący receptor kinazy tyrozynowej (ang. proto-oncogene encoding
receptor tyrosine kinase)
RET/PTC - rearanżacja RET występująca w raku brodawkowatym tarczycy RT - radioterapia
SST - somatostatyna T3 - trójjodotyronina T4 - tyroksyna Tg -tyreoglobulina
TP53 - gen kodujący czynnik transkrypcyjny p53,
TPO - enzym peroksydaza tarczycowa TRH - tyreoliberyna
TSH - hormon tyreotropowy (tyreotropina)
WBS -scyntygrafia całego ciała z użuciem izotopu jodu 131I (ang. whole body
scintigraphy)
7
2. WSTĘP
2.1. Zróżnicowany rak tarczycy
2.1.1. Rys historyczny
Zróżnicowany rak tarczycy jest najczęstszym nowotworem gruczołu tarczowego. Na przestrzeni dziejów możemy śledzić odkrycia i wkład najwybitniejszych uczonych w wiedzę o tym schorzeniu. Rozwój myśli lekarskiej, obserwacje i badania dały podłoże dzisiejszej medycynie, w tym endokrynologii. Trudno ustalić wydarzenie, które po raz pierwszy dało podstawy do rozwoju tyreologii, gdzie i kiedy miał początek fenomenu leczenia schorzeń tarczycy.
Pierwsze znane starożytne opisy wola pochodzą z okresu ok. 2700 r. p.n.e. Chiński Cesarz Shen Nung, twórca farmakoterapii chińskiej, stosował wodorosty w leczeniu powiększonej tarczycy. W tym też okresie, datowanym na 2697-2597r. p.n.e. odnajdujemy dowody na opisy guzów szyi, przedstawianych jako „nagromadzenie powietrza” i „nagromadzenie krwi”. W późniejszym okresie w księdze Shen Shi-Fan (420-501 r. n.e.) pojawiają się opisy przedstawiające zastosowanie tarczycy jelenia w leczeniu wola. W starych hinduskich księgach Vedy (Atharva-Veda) istnieją zaklęcia z okresu ok. 2000 r. p.n.e. skierowane przeciwko wolu. Z Egiptu, z 1500 r. p.n.e., pochodzą najdłuższe znane papirusy medyczne, zwane Papirusami Ebersa, mówiące o leczeniu chirurgicznym guzów szyi. Również wśród rzymskich autorów odnajdujemy wzmianki dotyczące występowania dużej szyi wśród Galów [1]. W I wieku p.n.e. i w II wieku n.e. informacje z przeprowadzanych operacji wola pochodzą od Aulusa Corneliusa Celsusa (53-7 p.n.e.), który był autorem dzieła „Artes” poświęconego sztuce lekarskiej i Claudiusa Galenusa (Galen) (129-199 r. n.e.), którego niektóre teorie medyczne były uznawane do XVIII wieku [1,2]. Galen jest prawdopodobnie także twórcą pierwszych rysunków przedstawiających powiększoną tarczycę. Przypuszczalnie z VII wieku n.e., opisy wycinania „bronchocele”, określanego jako duży guz z przodu i w dolnej części szyi, pochodzą od bizantyńskiego lekarza Paul’a of Aegina. Ważne miejsce w kształtowaniu medycyny zajął arabski lekarz i autor podręcznika chirurgii Abul Kasim (Albucasis z Cordoby), który w 961 r. przedstawił schemat usunięcia powiększonej tarczycy opisując ją jako „elephant of the throat” [1,3]. Wiedzy
8 o przeprowadzanych w średniowieczu operacjach, z zastosowaniem gorącego żelaza, setonów i sproszkowanego ziela Asphodel, dostarczyła w XII-XIII wieku, będąca kolebką chirurgii, pierwsza europejska szkoła medyczna z Salerno we Włoszech [2,4,5]. W 1316 r. powstaje „Anathomia”, której autorem jest Mundinus Liucius (1270-1326). W rozdziale „De anatomia Vegas guidem” autor przedstawia opisy gruczołów „amigdalae” lokalizacyjnie odpowiadające płatom tarczycy [7]. Około 1500 r. odnajdujemy rysunki i opisy tarczycy wykonane przez Leonardo da Vinci (1452-1519), przedstawiające gruczoł tarczowy w postaci kulistej dwuczęściowej struktury. Flamandzki uczony Andreas Vesalius (1515-1564), określany twórcą nowożytnej anatomii, jako jeden z pierwszych w swoim dziele "Budowa ludzkiego ciała" (De humani corporis fabrica, „Fabrica”) opisał tarczycę nazywając ją gruczołem krtaniowym. „Fabrica” była pierwszym drukowanym dziełem o anatomii człowieka, w którym Wesaliusz dokonał poprawek błędów anatomicznych Galena. Włoskiemu anatomowi Bartolomeo Eustachi (1520-1574) przypisuje się użycie po raz pierwszy określenia „tarczyca”, podczas gdy w 1656 r. w Londynie, anatom Thomas Wharton (1614-1673) stosuje nazwę „gruczoł tarczowy” [1,2].
Najwcześniejsze wzmianki o funkcji tarczycy pochodzą z XIV w., kiedy sądzono, że jej rolą jest nawilżanie tchawicy oraz ochrona naczyń krwionośnych [7]. W XVII wieku dodatkowo przypisano tarczycy pełnienie funkcji kosmetycznej u kobiet. Na początku 1800 r. uważano, że służy jako zastawka w przepływie krwi do mózgu [6]. Przełom przyniósł wiek XIX. W 1891 r., pionier w leczeniu chorób tarczycy, George Redmayne Murray (1865-1939), otrzymał dobrą odpowiedź kliniczną na podanie wyciągu owczej tarczycy osobom z niedoczynnością gruczołu tarczowego [6,10]. W swoim dziele „Operative story of goitre” Wiliam Halsted (1852-1922) przedstawił pierwsze operacje wola z użyciem skalpela, opisując zabiegi na tarczycy przeprowadzone w latach 1596-1800. Najbardziej dokładny i najwcześniejszy opis operacji wola u 10-letniej dziewczynki pochodzi z 1648 r. Jego autorem jest niemiecki lekarz Wilhelm Fabricus (Guilhelmus Fabricius Hildanus) (1560-1634). W 1791 r. w Paryżu francuski anatom i chirurg Pierre Joseph Desault (1738-1795) przedstawił zabieg częściowego usunięcia wola. Również w Paryżu, w roku 1808, francuski chirurg Guillaume Duputren (1777-1835) przeprowadza udokumentowane całkowite usunięcie powiększonej tarczycy [4,9]. Istotnym w rozwoju chirurgii tarczycy był fakt wykonania w 1885 r., przez Jana
9 Mikulicza-Radeckiego (1850-1905), częściowego usunięcia gruczołu w celu uniknięcia uszkodzenia nerwów krtaniowych wstecznych. Tak przeprowadzony zabieg zapobiegał wystąpieniu objawów pooperacyjnej niedoczynności tarczycy [8].
Początek XIX wieku przyniósł odkrycie jodu, wyizolowanego z morskich wodorostów w 1811 r. Dokonał tego francuski chemik Bernard Courtois (1777–1838). Pięć lat później, w 1816 r., również francuski chemik Joseph Louis Proust (1754-1826) zaleca stosowanie jodu, a już w roku 1820 szwajcarski lekarz Jean-Francois Coindet (1774-1834), wprowadza jod do leczenia wola [1]. W tym też okresie odnotowano pierwsze wyniki leczenia jodem [1,3,5]. W 1896 r. niemiecki chemik Eugen Baumann (1846-1896) odkrywa obecność jodu w tarczycy oraz fakt, że gruczoł tarczowy jest jedyną tkanką zawierającą jod [11]. Kolejne badania zakończone opisaniem, nadaniem nazwy i wyizolowaniem tyreoglobuliny przez Adolfa Oswalda (1870-1956) przypadają na lata 1899 i 1901. W 1914 r. amerykański biochemik Edward Calvin Kendall (1886 1972) uzyskał tyroksynę w formie krystalicznej, a w 1926 r. angielski chemik Robert Harington (1897-1972) opracował jej wzór chemiczny i zsyntetyzował ją w 1927 r. [1,6,14,15]. 25 lat później, w 1952 r., J. Gross i R. Pit-Rivers uzyskują syntetyczną trójodotyroninę [6,16].
Szwajcarski chirurg Emil Theodor Koecher (1841-1917), w 1909 r. otrzymał Nagrodę Nobla w dziedzinie fizjologii i medycyny za pracę nad fizjologią, patologią i chirurgią gruczołu tarczowego [14].
Pierwsze wzmianki dotyczące raka tarczycy pochodzą również z początku XIX wieku. Szczegółowy opis guzów jak i innych patologii tarczycy znajdujemy w podręczniku z 1823 roku „Observations on the surgical anatomy of the head and neck” autorstwa Allana Burns’a [12,17]. W 1822 r. M. J. Chetuins określa nazwą „struma scirrhosa” zmianę, przy której wymienia cechy takie jak: guzowatość, twardą konsystencję, silny rwący ból, duszność, naciek na tchawicę i mięśnie, a w końcowym etapie przekształcenie w raka. Austriacki chirurg Theodore Billroth (1829-1894) w 1855 r. podał prawdopodobnie pierwszy opis przerzutu raka tarczycy do węzłów chłonnych, opisując guza tarczycy z powiększonymi węzłami chłonnymi o takiej samej morfologii jak guz [18].
Jeden z pierwszych podziałów histologicznych raka tarczycy powstał w 1876 roku. Dokonał tego niemiecki lekarz i patolog Julius Friedrich Cohnheim (1839-1884)
10 [12,18]. W 1924 r. pojawiają się określenia kryteriów złośliwości guzów tarczycy. Amerykański histolog Graham Allen podaje kryteria guza złośliwego: wznowa, makroskopowa, inwazja miejscowa, przerzut i zgon. Dalsze obserwacje „przerzutów wola niezłośliwego” z uwzględnieniem cech histologicznych pozwalają ustalić dwa kryteria nowotworu: inwazja guza i obecność przerzutów odległych [12,13]. Późniejszą klasyfikację raka, z podziałem na anaplastycznego (niezróżnicowanego) oraz zróżnicowane (brodawkowaty i pęcherzykowy), a także podstawowe obserwacje, dostarczył Thomas Peel Dunhill w 1931 r. Kolejne ważne prace opublikowali G. Crile w 1948 r., W. Money i R. Rawson w 1950 r., G. Crile i J. Hazard w 1953 r., S. Warren i W. Meissner w 1953 r., G. Crile w 1957 r. [19]. Od 1914 r. w leczeniu raka tarczycy stosowano radioterapię [18]. Saul Hertz w 1936 r. proponuje użycie radioaktywnego jodu do badań nad tarczycą. Do roku 1938 Hertz i fizycy Robley Evans i Arthur Roberts wykonują szereg doświadczeń z zastosowaniem izotopu jodu 128I u królików [20,21,22].
W 1939 r. Joseph Hamilton, Mayo Soley i John Lawrance odkrywają izotopy jodu 130I
oraz 131I. Przełomowy stał się rok 1941 r., w którym Hertz i Robertz, Hamilton
i Lawrance, a także Charles LeBlond i Sue przedstawiają pierwsze wyniki badań z zastosowaniem 131I w nadczynności tarczycy. W tym też okresie odnotowano po raz
pierwszy wychwyt radiojodu przez nowotwór gruczołu tarczowego [12,23,24,25,26]. WPolsce, jod promieniotwórczy w diagnostyce i leczeniu chorób tarczycy, jako pierwszy zastosował w 1956 r. Maciej Gembicki, wówczas młodszy asystent w II Katedrze i Klinice Chorób Wewnętrznych Akademii Medycznej w Poznaniu. W Polskim Archiwum Medycyny Wewnętrznej odnajdujemy pracę z 1959 r. pt.: ” Własne doświadczenia dotyczące zastosowania promieniotwórczego izotopu jodu w badaniu czynności tarczycy” [27].
Prawdopodobnie pierwsze udokumentowane badania oceniające funkcję przysadki przeprowadzono w 1916 r. Bennett Allen oraz Philip Smith obserwowali zmiany zachodzące w tarczycy kijanek po usunięciu przedniej części przysadki. W 1922 r. Philip Smith i Irene Smith wykazali u aksolotlów pozytywną odpowiedź na stymulację niedoczynnej tarczycy ekstraktem bydlęcej przysadki [28,29]. W roku 1926 Eduard Uhlenhuth z Uniwersytetu Medycznego w Maryland po raz pierwszy pokazał wydzielanie przez przedni płat przysadki „stymulatora” tarczycy. Również potwierdził
11 stymulujące działanie wyciągu przysadki bydlęcej na tarczycę salamandr. Podobne wyniki uzyskali Leo Loeb i Max Aaron w 1929 r. u świnek morskich [28].
Od 1946 r. wykorzystywano tyreotropinę do zwiększenia wychwytu jodu przez raka tarczycy, początkowo podając pacjentom wołową TSH. Wiązało się to z występowaniem wielu działań niepożądanych: gorączki, bólu, stwardnienia w miejscu podania, pokrzywki, wstrząsu anafilaktycznego i zgonów [30,31]. W 1953 r. wyizolowano tyreotropinę za pomocą chromatografii jonowymiennej. Dalsze prace prowadzone przez Johna Pierce’a pozwoliły pod koniec lat 50-tych XX wieku rozdzielić peptydowe łańcuchy bydlęcego TSH [28]. W latach 60-tych i 70-tych ubiegłego stulecia określono strukturę podjednostki α i β tyreotropiny. W kolejnym dziesięcioleciu K. Tatsumi, P Guidon i F. Wondisford niezależnie opublikowali wyniki swoich prac na temat struktury podjednostki β ludzkiego TSH [28,32,33]. W tym samym okresie sklonowano gen tej podjednostki.
Rekombinowany ludzki hormon tyreotropowy (rhTSH) został zarejestrowany i otrzymał pozwolenie na dopuszczenie do obrotu w Unii Europejskiej 9 marca 2000 r. (nr pozwolenia na dopuszczenie do obrotu: EU/1/99/122/001 oraz EU/1/99/122/002). W USA FDA (Food and Drug Administration) wydała zgodę na zastosowanie rhTSH do stymulacji tyreoglobuliny i scyntygrafii diagnostycznej z użyciem izotopu jodu 131I w 1998 r., natomiast w 2005 r. EMEA w Europie (European
Medicine Agency) i w 2007 r. FDA w USA zatwierdziły użycie rhTSH do ablacji resztkowej tkanki tarczycowej, po strumektomii, u pacjentów ze zróżnicowanym rakiem tarczycy.
2.1.2. Epidemiologia raka tarczycy
Rak tarczycy (RT) stanowi <1% wszystkich nowotworów występujących w organizmie człowieka. Jest najczęstszym nowotworem złośliwym gruczołów wydzielania wewnętrznego. W Polsce, w ostatnich latach, notuje się rocznie blisko 2100-2200 nowych zachorowań na RT. Według danych z Krajowego Rejestru Nowotworów
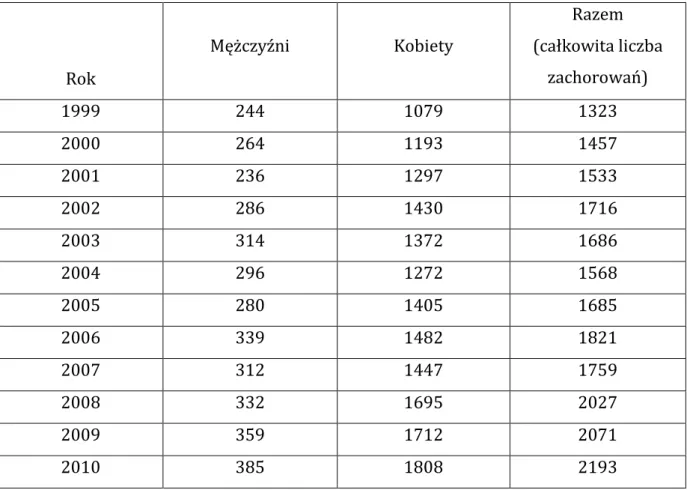
12 w 2010 r. zanotowano liczbę zachorowań na RT odpowiednio 384 dla mężczyzn i 1808 dla kobiet. Rak tarczycy był przyczyną 74 zgonów mężczyzn i 187 kobiet w 2010 r. Współczynnik standaryzacji zachorowań wyniósł 1,5/100000 dla mężczyzn i 6,7/100000 dla kobiet. U dzieci i nastolatków RT występuje rzadko. Stwierdza się wzrost zachorowań wraz z wiekiem. Średni wiek dla zróżnicowanego raka tarczycy (ZRT) to 45-50 r.ż. Liczba zachorowań na ZRT stale rośnie, co może wynikać w dużej mierze z lepszej i skuteczniejszej diagnostyki. Okres 10 lat przeżywa 85%-95% pacjentów z ZRT [152,153].
Tabela 1. Zestawienie liczby zachorowań na RT w Polsce w latach 1999 – 2010. Dane
z Krajowego Rejestru Nowotworów w Polsce.
Rok Mężczyźni Kobiety Razem (całkowita liczba zachorowań) 1999 244 1079 1323 2000 264 1193 1457 2001 236 1297 1533 2002 286 1430 1716 2003 314 1372 1686 2004 296 1272 1568 2005 280 1405 1685 2006 339 1482 1821 2007 312 1447 1759 2008 332 1695 2027 2009 359 1712 2071 2010 385 1808 2193
13
2.1.3. Czynniki ryzyka i ocena rokowania
Wśród czynników ryzyka rozwoju ZRT na pierwszym miejscu wymienia się promieniowanie jonizujące. Wzrost zachorowań jest zależny od dawki promieniowania i wieku narażenia, szczególnie u dzieci przed 10 rokiem życia. Nowotwory te cechuje większy stopień złośliwości. Przewagę stanowią guzy nieotorebkowane, z krótszym okresem utajenia, obecnością przerzutów odległych do płuc oraz węzłów chłonnych szyi [34,35]. Znaczący wpływ promieniowania jonizującego odnotowano w obserwowanej populacji dzieci po wybuchu elektrowni atomowej w Czarnobylu oraz u osób napromieniowanych w wyniku testów z użyciem bomby atomowej, przeprowadzonych w archipelagu Wysp Marshalla [44,45]. W tej grupie około 92% nowotworów stanowiły raki brodawkowate tarczycy (PTC, ang. papillary thyroid carcinoma) [45]. U osób poddanych radioterapii na okolicę głowy i szyi wzrasta ryzyko wystąpienia ZRT około 10-20 lat po napromieniowaniu. Ryzyko wzrasta od dawki 10 cGy do 1500 cGy, a zależność między dawką a prawdopodobieństwem wystąpienia ZRT jest liniowa. Powyżej 1500 cGy ryzyko wystąpienia raka maleje [40]. W populacji osób z niedoborem jodu w diecie obserwuje się większy odsetek zachorowań na raka pęcherzykowego (FTC, ang. Follicular thyroid carcinoma) i anaplastycznego (ATC, ang. Anaplastic thyroid carcinoma) niż PTC. Duża podaż jodu zwiększa odsetek PTC [36,37,40]. Czynnikiem ryzyka ZRT jest także rodzinne występowanie nowotworu, w szczególności PTC. Dotychczasowe doniesienia wskazują na większą agresywność postaci rodzinnej. Zwiększony odsetek PTC obserwuje się u chorych z zespołem Gardnera, chorobą Cowdena i zespołem Carney’a [36,38,39,47]. W grupie czynników prognostycznych należy wymienić wiek, płeć, wielkość guza, tempo wzrostu, obecność przerzutów w chwili rozpoznania choroby, obustronne występowanie, typ histologiczny. Niekorzystnymi rokowniczo są wiek <15 i >45 r.ż. [38,42,43], płeć męska, odosobniony guz >4cm, szybkie tempo wzrostu guza, obustronne występowanie zmiany, wieloogniskowość, przerzuty do węzłów chłonnych szyi oraz przerzuty odległe, cechy naciekania w badaniach obrazowych, niski wychwyt izotopu 131I lub jego brak
[36,40,46].
Do rozwoju ZRT predysponują czynniki genetyczne. Somatyczne mutacje genu RET, kodującego błonowy receptor dla czynników wzrostowych, o aktywności kinazy
14 tyrozynowej są spotykane u 20% osób ze sporadyczną postacią PTC i u 50-80% chorych po wcześniejszej ekspozycji na promieniowanie jonizujące [47,48]. W 40-70% PTC rearanżacje protoonkogenu RET występują u dzieci i młodzieży [49,50]. Aktywują one niezależny od TSH wzrost komórek tarczycy. Najczęściej występującą izoformą jest RET/PTC1 (60-70%), RET/PTC2 (5%) i RET/PTC3 (20-30%). Rearanżację RET/PTC3 stwierdzano częściej u dzieci narażonych na promieniowanie jonizujące po wybuchu elektrowni atomowej w Czarnobylu. Jest ona powiązana z bardziej agresywnym typem nowotworu i gorszym rokowaniem [50,51,52].
Najczęściej w PTC występuje mutacja genu BRAF, zlokalizowanego na chromosomie 7. Białko B-Raf jest kinazą serynowo-treoninową silnie aktywującą szlak kinaz aktywowanych mitogenami (MAPK, ang. mitogen-activated protein kinases). Najczęstszą mutacją genu BRAF jest mutacja punktowa polegająca na zamianie tymidyny na adeninę w pozycji 1799 (T1799A) w eksonie 15. Ostatecznie prowadzi to do zmiany waliny na glutaminian w pozycji 600 (V600E) [54]. Mutacja ta częściej występuje w klasycznej i wysokokomórkowej postaci PTC. Rzadsze występowanie odnotowano w ATC i niskozróżnicowanym RT (PDTC, ang. Poorly differentiated thyroid carcinoma), wywodzącymi się z PTC. Nie stwierdzono jej w FTC, gruczolakach, raku rdzeniastym tarczycy (RRT, MTC ang. Medullary thyroid carcinoma), raku wywodzącym się z komórek Hürthla (HCC, ang. Hürthle cell carcinoma) [53,54,55]. Występowanie mutacji BRAF wiąże się z obecnością przerzutów, większym ryzykiem nawrotu choroby, bardziej agresywnym przebiegiem i utratą zdolności gromadzenia jodu [56,57]. Rearanżacje genu NTRK1, kodującego błonowy receptor o aktywności kinazy tyrozynowej, stwierdza się w 2 - 25% przypadków PTC. Ich występowanie jest czynnikiem niekorzystnym rokowniczo [52,58]. U 70-95% chorych z PTC oraz 25% z FTC występuje nadekspresja onkogenu MET, kodującego receptor o aktywności kinazy tyrozynowej, która wiąże się z występowaniem przerzutów, wieloogniskowością tego typu nowotworów, a także z krótszym czasem przeżycia [59,60]. W FTC, PTC oraz w gruczolakach tarczycy spotyka się mutacje genów RAS. Częstotliwość mutacji RAS w PTC wynosi 10-20% i jest powiązana z wariantem pęcherzykowym PTC, wystąpieniem guza otorebkowanego, z rzadszą obecnością przerzutów do węzłów chłonnych. Stwierdzono, że 40-50% tych mutacji występuje w FTC o większej agresywności, z przerzutami do kości. Mutacje RAS są spotykane w 18-27% PDTC oraz w 50-60% w ATC. W FTC wykryto obecność
15 rearanżacji PAX8/PPARγ, powstałej w wyniku translokacji obejmującej fuzję genów PAX8 i PPARγ. Obecność tych rearanżacji jest powiązana z większą inwazyjnością guza. Rzadziej występują w gruczolakach pęcherzykowych, wariancie pęcherzykowym PTC i w mniejszym stopniu w HCC [47,48,61].
2.1.4. Charakterystyka zróżnicowanego raka tarczycy
2.1.4.1. Rak brodawkowaty tarczycy
Rak brodawkowaty tarczycy (PTC) jest guzem pochodzenia nabłonkowego, stanowi 65-95% przypadków ZRT. Komórki pęcherzykowe tworzące nowotwór posiadają charakterystyczne cechy diagnostyczne. Przy końcach struktur brodawkowatych stwierdza się obecność uwapnionych, kulistych ciałek piaszczakowatych. Duże, nakładające się na siebie okrągłe lub owalne jądra komórkowe, z wgłobieniami cytoplazmy, pozbawione są jąderek. Rozproszona chromatyna, barwiąca się równomiernie daje „obraz matowego szkła„ określany też obrazem „Orphan Annie eyses”. Rzadko widoczne są figury mitotyczne, ich zwiększona ilość wskazuje na nieprawidłowe różnicowanie i bardziej agresywny typ raka [40,63,64]. Rak brodawkowaty tarczycy daje najczęściej przerzuty do węzłów chłonnych szyi przedziału centralnego, bocznych i węzłów chłonnych śródpiersiowych. Znacznie rzadziej (5-10% przypadków) spotyka się przerzuty odległe, głównie do płuc i kości [75,76,77,78]. Naciekanie głębokich tkanek szyi, w tym tchawicy i mięśni wiąże się z bardziej agresywną postacią PTC. Do niekorzystnych rokowniczo wariantów histologicznych należy PTC zbudowany z komórek wysokich (tall-cell), występujący częściej u starszych mężczyzn, z pozatarczycową manifestacją i średnicą guza >5cm. Typ kolumnowy (columnar cell) charakteryzuje się agresywnym wzrostem i obecnością przerzutów odległych. Podtyp PTC z rozległym stwardnieniem (diffuse sclerosing variant) nacieka naczynia limfatyczne i węzły chłonne, daje przerzuty do płuc [38,65]. W około 20% - 80% przypadków występuje wieloogniskowo, w około 30% stwierdza się lokalizację obustronną (w obu płatach tarczycy) [40,62]. W przypadku odróżnicowania komórek może rozwinąć się ATC o bardzo złym rokowaniu. Nawrót PTC spotyka się u 5-20% chorych [40]. Szczyt zachorowań na PTC przypada na 30-50 r.ż. Nowotwór ten jest
16 zazwyczaj jodochwytny [62,65]. W diagnostyce PTC znaczenie ma biopsja aspiracyjna cienkoigłowa, wykonana pod kontrolą USG. Badanie to cechuje się 80 - 90% czułością, która w połączeniu z oznaczeniem stężenia tyreoglobuliny (Tg) wzrasta do 90 - 100% [66,67]. Rokowanie w PTC jest bardzo dobre ponieważ ponad 90% chorych przeżywa 10 lat [73].
2.1.4.2. Pęcherzykowy rak tarczycy
Rak pęcherzykowy tarczycy stanowi 10-30% RT. Jest guzem otorebkowanym, pochodzenia nabłonkowego, bez charakterystycznych, jak w przypadku PTC, cech jąder komórkowych. Budowa histopatologiczna nie pozwala na zróżnicowanie raka pęcherzykowego i gruczolaka, dlatego biopsja aspiracyjna cienkoigłowa (BACC) w tym wypadku nie jest metodą diagnostyczną [68]. Cechą różnicującą FTC od gruczolaka pęcherzykowego jest stwierdzona w FTC inwazja torebki i naczyń krwionośnych [40]. Rak z rozległą inwazją (typ z szeroką inwazją) ma znacznie gorsze rokowanie w porównaniu do typu minimalnie inwazyjnego [72,73]. U 10-20 % chorych stwierdza się obecność przerzutów odległych, zlokalizowanych głównie w płucach i kościach jako wynik rozsiewu krwiopochodnego. Rzadko natomiast przerzuty zajmują węzły chłonne [40,41,69]. Nawrót choroby obserwuje się u 5-20% chorych z FTC. Bardziej agresywną odmianą FTC jest przeważnie niejodochwytny nowotwór z komórek Hürthle’a (HCC) o takich samych kryteriach złośliwości [40]. Występuje częściej na terenach bogatych w jod oraz u osób po napromienianiu szyi. Również częstsze w przypadku HCC w porównaniu z FTC są przerzuty do węzłów chłonnych. Zarówno FTC i HCC produkują tyreoglobulinę (Tg) [40,69]. Inną odmianą FTC, o złym rokowaniu, jest niskozróżnicowany rak wyspowy. Na ogół jest on niejodochwytny z cechami naciekania torebki i naczyń oraz obecnością ognisk martwicy. Komórki tego guza układają się w charakterystyczne skupiska - „wyspy”. Rak pęcherzykowy tarczycy jest najczęściej rozpoznawany po 45 r.ż. iprzeważnie w wyższym stopniu zaawansowania niż to obserwuje się w PTC oraz cechuje się gorszym przebiegiem klinicznym.
17
2.1.5. Objawy i diagnostyka
Zróżnicowany rak tarczycy we wczesnych stadiach jest bezobjawowy. Najczęściej jest guzem przypadkowo wykrytym przez pacjenta lub podczas badania ultrasonograficznego. Zaawansowane stadium guza objawia się widocznym powiększeniem obwodu szyi, szybko rosnącym twardym guzkiem w tarczycy, o wzmożonej spoistości i nierównej powierzchni. Inne objawy zaawansowanego RT to chrypka, dysfagia, duszność, rzadziej ból, objawy przerzutów. Tylko w rzadkich przypadkach ZRT są guzami hormonalnie czynnymi z mogącymi im towarzyszyć objawami nadczynności tarczycy [70,71,74]. Badania diagnostyczne w przypadku podejrzenia RT obejmują badanie podmiotowe, przedmiotowe, USG szyi z BAC (tarczycy, węzłów chłonnych), oznaczenie stężenia tyreotropiny (TSH), RTG klatki piersiowej w dwóch projekcjach, stężenia Ca2+ w surowicy krwi, ocena laryngologiczna funkcji
strun głosowych, scyntygrafię szyi. Dodatkowe badania obrazowe służą ocenie zaawansowania i operacyjności guza (tomografia komputerowa, scyntygrafia kości, usg jamy brzusznej) [68,80,83].
2.1.6. Leczenie i monitorowanie zróżnicowanego raka tarczycy
2.1.6.1. Leczenie operacyjne
Leczeniem z wyboru jest operacyjne usunięcie tarczycy w przypadku rozpoznania nowotworu w BACC lub w sytuacji podejrzenia nowotworu pęcherzykowego. W przypadku stwierdzonego pojedynczego PTC o średnicy ≤ 10mm, bez cech zajęcia węzłów chłonnych przez nowotwór, po uzyskaniu zgody pacjenta, dopuszcza się usunięcie płata tarczycy z cieśnią. Również usunięcie płata z cieśnią, jako zabieg minimalny, jest dopuszczalne w sytuacji podejrzenia nowotworu pęcherzykowego w BACC, gdy stwierdzono pojedynczy guzek w tarczycy. W tych dwóch sytuacjach oraz gdy rozpoznano minimalnie inwazyjnego raka pęcherzykowego (pT1a), jeśli nie stwierdza się obecności przerzutów odległych i do węzłów chłonnych, można
18 odstąpić od całkowitego wtórnego wycięcia tarczycy. Ilość pozostałej po operacji objętości tkanki tarczycowej, oceniona w badaniu ultrasonograficznym, służy do oceny radykalności zabiegu [68]. Pozostawienie objętości resztkowej tkanki tarczycowej <1ml po każdej stronie, określa się prawie całkowitym wycięciem tarczycy. Dodatkowo, w ocenie radykalności zabiegu, można posłużyć się badaniem jodochwytności oraz badaniem scyntygraficznym tarczycy. W warunkach stymulacji rhTSH jodochwytność nie powinna przekraczać 1%, a w przypadku dokonywanej oceny w warunkach endogennej stymulacji 5%. Jeśli nie stwierdzono cech zajęcia przez nowotwór centralnych węzłów chłonnych szyi (grupy VI oraz przedziału środkowego szyi) zaleca się ich profilaktyczne usunięcie. Można rozważyć odstąpienie od operacji tej grupy węzłów gdy wielkość nowotworu nie przekracza 1 cm i nie stwierdzono cech ich zajęcia w USG przedoperacyjnym oraz w trakcie zabiegu. W przypadku przerzutów ZRT do bocznych węzłów chłonnych szyi (potwierdzonych w badaniu BACC lub w biopsji śródoperacyjnej) zalecana jest jednostronna lub obustrona limfadenektomia, z pozostawieniem żyły szyjnej, mięśnia mostkowo-obojczykowo-sutkowego i nerwu XI [68]. Porażenie nerwu krtaniowego wstecznego i pooperacyjna niedoczynność przytarczyc są najczęstszymi powikłaniami operacyjnego leczenia RT. Pooperacyjny stopień zaawansowania nowotworu ocenia się według Klasyfikacji TNM dla raka tarczycy zgodnie z wytycznymi UICC (Międzynarodowej Unii Przeciwrakowej, ang. Union for International Cancer Control) 2010 [68,79].
19
Tabela 2. Klasyfikacja TNM/UICC 2010
(Źródło: Sobin L, Gospodarowicz M, Wittekind C. Thyroid gland. TNM Classification of Malignant Tumors. Wyd. 7. Blackwell Publishing 2010: 58–62)
T guz pierwotny
Tx nie można ocenić guza pierwotnego T0 brak guza pierwotnego
T1 guz w największym wymiarze nieprzekraczający 2cm, ograniczony do tarczycy
T1a guz ≤ 1cm
T1b guz >1cm i ≤ 2cm
T2 guz >2cm i ≤ 4cm, ograniczony do tarczycy
T3 guz >4cm ograniczony do tarczycy lub każdy guz nieznacznie przekraczający torebkę tarczycy z niewielkim naciekaniem np. mięśnia mostkowo- gnykowy lub tkanek miękkich około tarczycowych
T4a każdy guz wychodzący poza torebkę tarczycy naciekający podskórne tkanki miękkie, krtań, tchawicę, przełyk, nerw krtaniowy wsteczny
T4b guz naciekający powięź przedkręgową lub tętnicę szyjną lub naczynia śródpiersia
N regionalne węzły chłonne
Nx nie można ocenić regionalnych węzłów chłonnych N0 brak przerzutów do regionalnych węzłów chłonnych N1 obecność przerzutu do regionalnych węzłów chłonnych
N1a przerzuty do węzłów chłonnych przedziału VI(przedział środkowy szyi)- przedtchawiczych, okołotchawiczych, okołoktraniowych
N1b przerzuty do węzłów chłonnych bocznych szyi lub do węzłów śródpiersia górnego
M przerzuty odlegle
Mx brak możliwości oceny przerzutów odległych M0 brak przerzutów odległych
20
2.1.6.2. Leczenie izotopem jodu
131I
Terapia 131I obejmuje leczenie uzupełniające, radykalne oraz paliatywne.
Wskazaniem do leczenia uzupełniającego jest ablacja resztkowej tkanki tarczycy 131I
pozostałej po strumektomii radykalnej oraz zniszczenie ewentualnych mikroognisk raka w loży tarczycy, węzłach chłonnych oraz sterylizacji przerzutów odległych. Takie postępowanie zwiększa swoistość późniejszych badań scyntygraficznych całego ciała z 131I i oznaczeń Tg. Nie ma konieczności leczenie uzupełniającego w przypadku ZRT
w stadium pT1aN0M0. W sytuacji nowotworów z zaawansowaniem pT1b-T2N0M0, gdy stężenie Tg <1-2 ng/ml, przy niskiej jodochwytności w loży tarczycy, po streumektomii radykalnej, można odstąpić od ablacji resztkowej tarczycy [66,68,81]. Aktywności 131I
stosowane w leczeniu uzupełniającym obejmują najczęściej zakres 1,1 - 3,7GBq (30-100mCi) [68,81,82]. Leczenie radykalne stosowane jest u chorych z jodochwytnymi przerzutami odległymi. U osób z nieoperacyjnym guzem pierwotnym, nieoperacyjną wznową miejscową i w obecności przerzutów odległych o niskiej jodochwytności, niewystarczającej do sterylizacji, wskazana jest terapia paliatywna [68,84]. Spodziewanym efektem jej zastosowania jest zmniejszenie objętości guza i redukcja towarzyszących chorobie dolegliwości, głównie bólu. Przeciwskazaniem do leczenia 131I
jest ciąża oraz karmienie piersią. Zaleca się postępowanie antykoncepcyjne po terapii izotopowej 12 miesięcy dla kobiet i 4-6 miesięcy dla mężczyzn [80,82,85,86].
Izotop jodu podawany jest doustnie w postaci kapsułek zawierających jodek (131) sodu. Możliwe jest również dożylne podanie izotopu. Wchłanianie jodu po podaniu doustnym odbywa się w żołądku i jelicie cienkim. Stężenie jodu w tyreocytach jest 20-40 razy większe niż w surowicy krwi. Gromadzenie 131I w tarczycy zachodzi przy
udziale symportera sodowo-jodowego (NIS, ang. sodium iodide symporter) poprzez transport aktywny jonu jodu (I-) do wnętrza komórki tarczycy z jednoczesnym
transportem dwóch jonów sodu (Na+). Gradient stężenia Na+ utrzymywany jest poprzez
aktywność ATPazy Na+/K+ [87,88,89]. NIS jest zlokalizowany w błonie
podstawno-bocznej tyreocyta. Transport jodków do koloidu odbywa się przy udziale białka pendryny, znajdującego się w części szczytowej tyreocyta [90,91]. Tyreoperoksydaza (TPO) będąca glikoproteiną błonową katalizuje utlenianie anionów jodkowych przy wykorzystaniu nadtlenku wodoru (H2O2) oraz wiązanie jodu z resztami tyrozolowymi
21 Tg. W obrębie Tg cząstki monojodotyrozyny (MIT) i dijodotyrozyny (DIT) łączą się tworząc trijodotyroninę (T3) i tyroksynę (T4), które są uwalniane do krwiobiegu w mechanizmie proteolizy Tg. Stymulatorem NIS jest TSH, stymulujący również ekspresję TPO oraz wytwarzanie H2O2 przez oksydazę. Synteza hormonów tarczycy
wymaga więc obecności NIS, Tg, TPO, pendryny [88,91].
Regulacja TSH odbywa się za pomocą zależnych od cAMP przekaźników sygnałów [92,99]. Brak TSH powoduje redystrybucję NIS, jego cytoplazmatyczną lokalizację oraz zmniejszenie jego ilości w błonie komórkowej. Nie stwierdza się również syntezy nowych cząsteczek NIS. Zmniejszenie ilości NIS na powierzchni tyreocyta wiąże się z utratą jodochwytności [93,94]. Według niektórych doniesień, przy nieobecności TSH okres półtrwania NIS ulega skróceniu z 5 do 3 dni [94]. Poziom ekspresji białka NIS jest obniżany przez Tg i jod [95,96].
W ZRT obserwuje się zmniejszenie lub zanik ekspresji białek TPO, Tg, NIS, PDS [91,97]. W niektórych badaniach wykazano ujemną korelację ekspresji NIS i zaawansowania ZRT [98]. Zmniejszoną ekspresję NIS lub jej brak stwierdzano w części przypadków przerzutów ZRT powstałych w wyniku progresji i odróżnicowania komórek, w zestawieniu z ogniskiem pierwotnym. Zmiany przerzutowe pochodzące z jednego guza pierwotnego mogą mieć różną ekspresję NIS. Jej wyraźne obniżenie zaobserwowano w przerzutach ZRT do węzłów chłonnych [98,99]. Utrata ekspresji NIS powoduje brak jodochwytności tkanki nowotworowej. Całkowity jej brak stwierdzono w ATC i HCC [99,100]. W innych doniesieniach wzrost ekspresji NIS w ZRT wiązał się z jego nieprawidłową, wewnątrzcytoplazmatyczną lokalizacją [101]. Obecność białka NIS oraz możliwość akumulacji jodu stwierdzono również w śliniankach, błonie śluzowej żołądka, gruczołach piersiowych w okresie laktacji, ciele rzęskowym oka, splocie naczyniówkowym, skórze, łożysku. Ponadto wykryto je w wielu innych narządach pozatarczycowych w tym w płucach, sercu, grasicy, mózgu, jelicie cienkim, okrężnicy, wątrobie, mięśniach szkieletowych, nerkach, śledzionie, leukocytach krwi obwodowej oraz w trzustce, nadnerczach, jądrach, prostacie i jajnikach. Zdolność gromadzenia jodu i aktywność NIS jest znacznie mniejsza w tkankach pozatarczycowych, w których nie podlega wpływom regulacyjnym TSH. Tkanki te nie mają zdolności organifikacji jodu[93].
22 W celu uzyskania jak najlepszego wychwytu 131I, 1 do 4 tygodni przed leczeniem
lub diagnostyką chory powinien stosować dietę z ograniczeniem jodu. Celem takiego działania jest uzyskanie jak najmniejszej zawartości jodu w organizmie [102]. Według niektórych doniesień zalecana jest dieta dwutygodniowa. Trwające 7-dni ograniczenie podaży jodu nie pozwala osiągnąć zamierzonego celu [104,105]. Dieta niskojodowa definiowana jest jako podaż jodu < 50 μg/dobę [103,104]. Zastosowanie rhTSH powoduje, że źródłem jodu jest lewotyroksyna podawana do ostatniego dnia przed leczeniem 131I.
Izotop jodu 131 w 37-75% wydalany jest z moczem, w 10% ze stolcem, wydzielany jest również do śliny, potu i mleka matki [106,107]. Okres półtrwania jodu w tarczycy (tzw. efektywny) trwa około 6 dni, natomiast w osoczu jest znacznie krótszy i wynosi około 12 godzin. Obniżenie aktywności 131I w organizmie jest dwufazowe.
Początkowo obserwujemy obniżenie aktywności o 40%, wynikające z efektywnego T1/2
wynoszącego 0,43 dnia. Dla pozostałej 60 % aktywności efektywny okres półtrwania wynosi 7,61 dnia [107,108]. Ponieważ większość izotopu jodu 131I jest wydalana
z moczem, w przypadku niewydolności nerek wymagana jest korekcja podawanej pacjentowi aktywności. Niewydolność nerek powoduje wzrost stężenie 131I w osoczu
oraz przedłużony czas jego eliminacji z ustroju [109].
Izotop jodu 131 podczas rozpadu emituje promieniowanie β (wykorzystywane w terapii) i γ (mające zastosowanie w diagnostyce). Promieniowanie β ma kilkumilimetrowy zasięg i powoduje destrukcje komórki. Efektem jego działania jest wytworzenie wolnych rodników uszkadzających organelle komórkowe. Zaburzone są funkcje wzrostu i podziału komórki, a końcowym efektem może być śmierć komórki. Bezpośrednim wynikiem działania promieniowania jonizującego jest również uszkodzenie struktury DNA. W obrębie naczyń krwionośnych błona wewnętrzna ulega obliteracji. Skutkiem działania izotopu jodu 131I jest powolna atrofia tkanki tarczycowej
[86, 105, 110, 111].
Leczenie 131I jest stosunkowo bezpieczne. Rzadko spotyka się skutki niepożądane
terapii. Najczęściej obserwujemy wczesne działania niepożądane, wśród których wymieniane są nudności, przemijające i samoistne zapalenie błony śluzowej żołądka, brak apetytu. Przejściowe zapalenie ślinianki, zaburzenia czucia smaku i węchu są najbardziej nasilonymi objawami ubocznymi spowodowanymi wychwytem 131I przez
23 ślinianki [112,113]. Rzadziej występują bóle i zawroty głowy, zmęczenie, obturacja kanalików łzowych ból i/lub obrzęk tkanki tarczycowej lub ognisk przerzutowych. Zapalenie tkanki tarczycy występuje głównie w sytuacji pozostawienia po strumektomii dużej ilości tkanki [114,115,116]. Późne powikłania występują rzadko. W tej grupie wymieniane są śródmiąższowe zwłóknienie płuc (w obecności przerzutów do płuc), przewlekłe zaburzenia funkcji ślinianek i gruczołów łzowych, przejściowe zahamowanie czynności szpiku [117,120,129]. Depresja szpiku powodująca leukopenię i trombocytopenię zależy od aktywności radjojodu podanej pacjentowi. Ryzyko uszkodzenia szpiku i wystąpienia białaczki zwiększa się po otrzymaniu przez pacjenta łącznej aktywności >18,5 GBq (500 mCi). Dodatkowo ryzyko to wzrasta po zastosowaniu radioterapii. Ciężkie uszkodzenie szpiku, najczęściej jednak przemijające, obserwuje się w przypadku przerzutów raka do szpiku [129,130]. Zaobserwowano ponadto przejściowe zaburzenia płodności, głównie związane z zaburzeniem czynności jąder i jajników [118,119,121,122]. Pojawiły się sprzeczne doniesienia o zwiększonym ryzyku poronień wśród kobiet, które otrzymały 131I do roku przed zajściem w ciąże. Inne
doniesienie tego nie potwierdzają [123,124]. Nie wykazano wystąpienia wad u potomstwa pacjentów poddanych terapii 131I [85,123,124]. W niektórych
doniesieniach przedstawione są dane na temat zwiększonego ryzyka wtórnych do leczenia radiojodem złośliwych nowotworów [125,126,127,128]. Wystąpienie skutków ubocznych terapii 131I zależne jest od skumulowanej aktywności otrzymanej przez
pacjenta oraz odstępów czasowych między kolejnymi cyklami leczenia. Po przekroczeniu łącznej aktywności 14 GBq (500 mCi) powinno się rozważyć korzyści podawania kolejnych aktywności 131I. Nie określono maksymalnej łącznej aktywności
podawanego 131I jeżeli korzyści dla pacjenta przeważają nad ryzykiem wystąpienia
działań niepożądanych.
Chorzy z ZRT po strumektomii całkowitej, a także po leczeniu 131I otrzymują
suplementację hormonów tarczycy (L-tyroksyny, LT4) w dawce zapewniającej stężenie TSH <0,1μIU/ml, bez ewidentnych objawów nadmiaru hormonów tarczycy. Celem takiego postępowania poza substytucją hormonalną jest zminimalizowanie ryzyka dalszego rozwoju raka lub jego nawrotu szczególnie w przypadku podwyższonego ryzyka choroby (jawne objawy choroby lub stymulowana Tg >1-2ng/ml) [68]. Warunkiem terapii 131I jest stężenie TSH co najmniej 20-30μU/ml, uzyskiwane poprzez
24 zaprzestanie leczenia tyroksyną w okresie 4-6 tygodni przed planowaną terapią radiojodem lub przy użyciu rhTSH. Takie stężenia TSH mają zapewnić stymulację komórek nowotworowych tarczycy oraz produkcję Tg [131,132,133,134]. U chorych z niedoczynnością przysadki lub innymi schorzeniami uniemożliwiającymi uzyskanie stymulacji TSH na drodze endogennej podanie rhTSH jest jedynym sposobem uzyskania warunków wymaganych do terapii 131I.
Przed leczeniem izotopem jodu należy przeprowadzić wywiad, badanie przedmiotowe, USG szyi. Wykonujemy oznaczenie stężenia Tg, miano przeciwciał przeciwtyreoglobulinowych (anty-Tg), stężenie TSH, morfologię krwi, stężenie wapnia zjonizowanego. Zaleca się wykonanie badania wydalania jodu z moczem [68,135,136]. Czas potrzebny do zagojenia rany, ustąpienia obrzęku po strumektomii, obniżenia stężenia Tg oraz ustąpienia lub zminimalizowania powikłań po zabiegu, umożliwiający tym samym podanie aktywności 131I to 4 tygodnie do 3 miesięcy od operacji. W celu
wykrycia jodochwytnych ognisk mogących odpowiadać resztkowej tkance tarczycowej i/lub przerzutom RT wykonywana jest scyntygrafia poterapeutyczna całego ciała (WBS, ang. Whole body scan). Najkrótszy czas po terapii, po którym można wykonać WBS wynosi 72 godziny. W sytuacji podejrzenia obecności przerzutów dodatkowo wykonywane są badanie radiologiczne klatki piersiowej (RTG), tomografię komputerową (CT) lub obrazowanie metodą jądrowego rezonansu magnetycznego (MRI), badanie scyntygraficzne kości (99mTcMDP), tomografia emisyjna pojedynczego
fotonu (SPECT), pozytronowej tomografii emisyjnej z wykorzystaniem znakowanej 18F
deoksyglukozy (18F-FDG-PET) oraz SPECT-CT, PET-CT [68,137,138,139]. Badanie CT
z kontrastem upośledza wychwyt radiojodu przez okres około 2 miesięcy [140,141].
2.1.6.3. Monitorowanie choroby
Około 3 miesiące po przeprowadzonym leczeniu 131I ocenie podlega stężenie TSH
w celu potwierdzenia uzyskania wartości supresyjnych. W przypadku konieczności modyfikacji dawki LT4 ponowną ocenę TSH wykonujemy najwcześniej po 6-8 tygodniach. Badanie USG, Tg wykonujemy pół roku po terapii. Ocenę skuteczności leczenia operacyjnego i ablacji tarczycy należy przeprowadzić 6-12 miesięcy od podania
25
131I. W jej zakres wchodzą badanie podmiotowe i przedmiotowe, USG szyi, Tg, anty-Tg,
badania oceniające nawrót choroby i ewentualne skutki uboczne terapii [142,143]. Celem wykrycia i lokalizacji choroby przetrwałej lub nawrotu ZRT, w sytuacji stwierdzenia wzrostu stężenia Tg w warunkach supresji lub stymulacji TSH można wykonać WBS. W zależności od ryzyka wznowy przeprowadzane są kolejne badania kontrolne. Wysoką czułość w wykrywaniu nawrotu ZRT ma jednoczasowe wykonanie USG szyi i ocena stymulowanej Tg [68, 142, 144].
Okres pierwszych 5 lat wymaga kontroli stężenia Tg oraz USG szyi co 6 miesięcy, w kolejnych 5 latach co 12 miesięcy. Po 10 latach obserwacji bez cech czynników ryzyka ZRT dopuszcza się kontrolę ultrasonograficzną i badanie stężenia Tg co 24 miesiące. W przypadku podejrzenia nawrotu choroby częstotliwość badań kontrolnych powinna być większa. Podejrzane o wznowę lub przerzut RT zmiany w obrębie szyi wymagają wykonania BACC. Oznaczanie stężenie Tg wymaga jednoczasowej oceny miana anty-Tg. Brak wzrostu stężenia Tg w warunkach stymulacji TSH, przy braku obecności przeciwciał anty-Tg oraz wykluczenie cech ZRT w badaniach obrazowych po całkowitej strumektomii i ablacji 131I są kryterium remisji choroby. W tej sytuacji dalsza ocena
stężenia Tg może być przeprowadzana w warunkach supresji TSH bez konieczności warunków stymulacji. Nie ma wskazań do rutynowej scyntygrafii diagnostycznej całego ciała jako elementu oceny remisji choroby [68].
Tyreoglobulina jest glikoproteiną biorącą udział w produkcji T3 i T4, stanowiącą magazyn dla hormonów tarczycy. Cząsteczka zawiera 0,1-1% jodu. Jest wytwarzana przez niezmienione chorobowo komórki pęcherzykowe tarczycy w zmianach łagodnych oraz w wysoko zróżnicowanych komórkach raka tarczycy. Produkowana jest także w wolu jajnikowym. Po całkowitej strumektomii i leczeniu ablacyjnym 131I Tg stanowi
czuły wskaźnik monitorowania przebiegu raka tarczycy w sytuacji niewykrywalnych przeciwciał anty-Tg. Wzrost stężenia Tg świadczy o wznowie lub progresji RT [145]. Przeciwciała przeciwtyreoglobulinowe obecne u około 20% pacjentów z ZRT zaburzają właściwą ocenę stężenia Tg i są przyczyną niedoszacowania lub nawet zawyżania jej stężenia. Wysokie miano przeciwciał anty-Tg lub jego wzrost może stanowić wyznacznik nawrotu choroby nowotworowej. Obniżenie miana lub brak przeciwciał są jednym z czynników korzystnych rokowniczo [146,147,148].
26 Utrzymująca się całkowita remisja od okresu ablacji 131I powinna być
potwierdzona badaniami kontrolnymi w warunkach stymulacji TSH po około 3 i 5 latach. W przypadku podejrzenia wznowy ZRT konieczne jest przeprowadzenie pełnej diagnostyki kontrolnej poszerzonej o dodatkowe badania obrazowe. Nawrót choroby, rozsiany proces nowotworowy, a także stymulowane stężenie Tg > 1-2ng/ml (również w przypadku braku cech choroby), wymagają utrzymywania TSH w zakresie stężeń supresyjnych. Utrzymanie wartości supresyjnych TSH należy rozważyć w sytuacji wysokiego ryzyka nawrotu ZRT. W przypadku potwierdzenia całkowitej odpowiedzi na leczenie, u chorych z pT1aN0M0, pT1bN0M0 oraz pT2N0M0 zaleca się stosowanie LT4 w dawkach substytucyjnych. U tych pacjentów można rozważyć niepełną supresję (stężenie TSH 0,1–0,4 mj./l). Po okresie 5-letnim pełnej remisji ZRT dopuszcza się leczenie dawkami substytucyjnymi LT4 (TSH <2-2,5mj./l). Pierwsze 5 lat jest okresem najczęstszego występowania nawrotu choroby [68,149,150].
2.1.6.4. Leczenie zaawansowanego ZRT
Ryzyko nawrotu ZRT oceniane jest na 5-20%. Nawrót choroby wiąże się z gorszym rokowaniem [151,152]. Śmiertelność pacjentów z wznową ZRT wg niektórych doniesień wynosi 12-69% [153,154]. Największą śmiertelność obserwuje się w grupie pacjentów z obecnością przerzutów odległych. Ryzyko zgonu jest większe wśród chorych ze stwierdzonym nawrotem lokoregionalnym niż z nawrotem miejscowym lub regionalnym oddzielnie. Badacze w swoich pracach oceniali częstość występowania wznowy ZRT. W jednej z opublikowanych prac miejscową wznowę zaobserwowano u 28% chorych, lokoregionalną i przerzuty odległe odpowiednio u 53% i 13% chorych [155]. Leczenie wznowy lokoregionalnej ZRT obejmuje operacyjne usunięcie zmiany, a przy istniejących wskazaniach terapię radiojodem [68,154,155,156]. W przypadku progresji zmian nieoperacyjnych i niejodochwytnych można zastosować teleradioterapię [68,157,158]. Chorzy ze stwierdzonymi przerzutami odległymi ZRT mogą być leczeni 131I w sytuacji potwierdzenia jodochwytności tych zmian [159,160].
Należy rozważyć leczenie operacyjne w obecności pojedynczej zmiany przerzutowej. Zgodnie z Rekomendacją Polskich Towarzystw Naukowych dla raka tarczycy pojedynczy
27 przerzut ZRT do ośrodkowego układu nerwowego (OUN) może być poddany leczeniu
131I w sytuacji trudnego dostępu operacyjnego, po potwierdzeniu jego jodochwytności
[68,161]. U części chorych obserwujemy progresję choroby z jednoczesnym brakiem wychwytu radiojodu w ogniskach ZRT, często o bardzo agresywnym przebiegu procesu nowotworowego. Metody leczenia opornego na izotop jodu 131I ZRT są ograniczone
[162]. Od kilku lat w ramach badań klinicznych stosowane są inhibitory kinaz tyrozynowych (TKI, ang. tyrosine kinase inhibitors).
Kinazy tyrozynowe są odpowiedzialne za prawidłowe funkcjonowanie komórki. Mutacja i nadekspresja kodujących je genów powoduje niekontrolowany wzrost i proliferację komórek, nasilenie procesów angiogenezy oraz zaburzenia procesu apoptozy. Efektem nieprawidłowego działania kinaz białkowych mogą być także tworzące się przerzuty RT [162,163]. Stosowanie TKI u chorych z opornym na leczenie
131I, zaawansowanym miejscowo lub rozsianym ZRT, wydłuża okres do progresji
choroby [164,165]. Rakami tarczycy opornymi na terapię radiojodem określa się niejodochwytne nowotwory, z podaną aktywnością skumulowaną 131I przekraczająca
600 mCi (22200 MBq) i/lub z progresją ognisk przerzutowych w trakcie leczenia 131I.
Warunkiem leczenia TKI jest stwierdzenie progresji wg kryteriów progresji choroby RECIST 1.1 (ang. Response Evaluation Criteria In Solid Tumors) [162]. W grupie TKI zarówno Sorafenib jak i Lenvatinib otrzymały pozytywną opinię Europejskiej Agencji Leków (EMA; European Medicines Agency) i zostały dopuszczone do obrotu w Unii Europejskiej odpowiednio w roku 2013 i 2015. W Polsce jednak leki te nie zostały objęte refundacją i praktycznie są niedostępne dla pacjentów. W sytuacji progresji niejodochwytnego ZRT dalsze leczenie jest więc dużym problemem terapeutycznym [164,165].
2.1.7. Hormon tyreotropowy
U niektórych pacjentów mimo odstawienia LT4 na okres 4-6 tygodni, stężenia TSH nie uzyskują wartości wymaganych. Często dotyczy to chorych ze zróżnicowanym rakiem tarczycy z współistniejącą niedoczynnością przysadki, chorych w podeszłym wieku, z obecnością przerzutów hormonalnie czynnych [166], czy z obecnością wola
28 jajnikowego [167]. Niedoczynność tarczycy poprzez wpływ na funkcje poszczególnych narządów szczególnie mózgu, serca, nerek i wątroby niekorzystnie oddziałuje na proces leczenia innych chorób [168]. Wykazano, że podwyższone stężenie TSH zwiększa ryzyko wzrostu resztkowej tkanki tarczycowej pozostałej po operacji i komórek ZRT obecnych we wznowie miejscowej i w przerzutach odległych [169,170]. Niedobór hormonów tarczycy może skutkować zmniejszeniem wskaźnika filtracji kłębuszkowej (GFR, ang. glomerular filtration rate), zmniejszeniem przepływu krwi przez nerki (RBF, ang. renal blond flow), zaburzeniami wzrostu nerek, hiponatremią, upośledzoną zdolnością wydalania wody z ustroju [171,172,179]. Pojawiły się doniesienia na temat wzrostu homocysteiny w tej grupie pacjentów [173]. Dotychczasowe wyniki badań potwierdzają wystąpienie podwyższonego stężenia cholesterolu całkowitego, frakcji LDL, triglicerydów [174]. W przewlekłej niedoczynności tarczycy wzrasta ryzyko nasilenia chorób sercowo-naczyniowych wynikające z niedoboru hormonów tarczycy. W tej grupie chorych obserwujemy występowanie zwolnienia tętna, zaburzenia kurczliwości komór, zwiększenie oporu obwodowego [175]. Ponadto dość często pojawiają się obniżenie nastroju, zaburzenia koncentracji [176,177]. Zwolnienie motoryki jelit oraz zaburzenia metabolizmu wątroby przyczyniają się do częstego występowania wzdęć i zaparć [178]. Wśród najczęściej obserwowanych objawów niedoboru hormonów tarczycy wymienia się także łatwe męczenie, przyrost masy ciała, nietolerancja zimna, obrzęki, spowolnienie ruchowe, chrypka, suchość skóry, parestezje, skurcze mięśni, osłabienie siły mięśniowej. U pacjentów ze ZRT endogenna stymulacja TSH wiąże się z wystąpieniem objawów niedoczynności tarczycy o różnym nasileniu. Ze względu na współwystępowanie innych ciężkich schorzeń, szczególnie u osób w starszym wieku, endogenna stymulacja TSH często nasila dolegliwości chorób towarzyszących, wpływa na pogorszenie ogólnego stanu zdrowia oraz na ryzyko ewentualnej progresji choroby. Niekorzystnie oddziałuje na stanpsychiczny i jakości życia.
Hormon tyreotropowy jest heterodimeryczną glikoproteiną o masie cząsteczkowej 28-30 kDa, wydzielaną przez komórki przedniego płata przysadki. Odpowiada za wzrost komórek pęcherzykowych oraz stymulację czynności wydzielniczej tarczycy. Regulacja wydzielania TSH zachodzi pod wpływem tyreoliberyny (TRH), somatostatyny (SST), dopaminy (DA), przy czym dwa ostatnie hormony hamują jej wydzielanie. Wpływ hamujący na biosyntezę TSH ma również T3
29 powstająca także w przednim płacie przysadki poprzez odjodowanie T4. Trójjdotyronina hamuje dodatkowo odpowiedź komórek tyreotropowych na TRH oraz ich proliferację. Na poziomie podwzgórza hormony tarczycy hamują syntezę TRH. Hormon tyreotropowy wydzielany jest pulsacyjnie, z zaznaczonym rytmem dobowym. Prawidłowe wartości stężeń TSH mieszczą się w przedziale 0,3(0,4) μU/ml 4,0(4,5) μU/ml w zależności od stosowanej metody oznaczeń. Wielu autorów postuluje obniżenie górnego zakresu referencyjnego do 3 μU/ml, a nawet 2,5 μU/ml.
Biologicznie aktywną formą TSH są połączone niekowalencyjnie podjednostki α i β. Gen podjednostki α znajduje się na 6 chromosomie, podjednostki β na chromosomie 1. Ekspresja genu podjednostki β dotyczy tylko 5 % komórek przedniego płata przysadki w odróżnieniu do uogólnionej ekspresji genu podjednostki α (komórki tyreotropowe, gonadotropowe, komórki łożyska) [180]. Około 2 razy większa podjednostka α (9,4 kb) zawiera 92 reszty aminokwasowe, w tym 10 reszt cysteiny połączonych mostkami disiarczkowymi. W pozycji 52 i 78 do asparaginy dołączone są dwa łańcuchy oligosacharydowe. Podjednostka α jest identyczna jak podjednostki α-LH, α-FSH, α-HCG. Podjednostka β (4,9 kb) jest różna dla poszczególnych hormonów i odpowiada za swoistość działania hormonu oraz określone właściwości wiązania z receptorem. Różnica w podjednostkach β dotyczy lokalizacji na chromosomie, długości poszczególnych podjednostek oraz ich struktury. Podjednostka β TSH złożona jest z 118 reszt aminokwasowych i jednego łańcucha oligosacharydowego połączonego z asparaginą w pozycji 23. Zawiera 12 reszt cysteiny połączonych 6 mostkami disiarczkowymi. Każda z podjednostek TSH zawiera dwie pętle (L1 i L3) o strukturze tzw. „szpilki do włosów” (harpin loop) po jednej stronie oraz jedną długą pętle (L2) po drugiej stronie centralnego węzła cystynowego, utworzonego przez 3 mostki disiarczkowe podjednostki β (Cys2-Cys52, Cys27-Cys83, Cys31-Cys85) [180,181,182]. Tyreotropina zawiera kilka ściśle określonych domen, w obrębie których niewielkie zmiany powodują zaburzenia rozpoznawania i wiązania z receptorem TSH (TSHR), zmienioną aktywność biologiczną hormonu [180]. Węglowodany stanowią 15 - 25% masy hormonu. Przyłączenie reszt cukrowych zachodzi podczas potranslacyjnej modyfikacji cząsteczki. Prawidłowa glikozylacja odpowiada za wydłużony okres półtrwania TSH w osoczu, aktywność biologiczną, stabilność TSH, łączenie podjednostek i wydzielanie dimeru, nasilenie zdolności aktywacji TSHR. Różnorodność struktur
30 oligosacharydowych powoduje fizjologiczne występowanie izoform tyreotropiny o różnej aktywności [180,182]. Cukry proste zlokalizowane na nieredukujących końcach oligosacharydów wpływają na szybkość eliminacji glikoprotein z układu krążenia. Tyreotropina zawiera oligosacharydy w większości zakończone SO4
GalNAc(β1-4)GlcNAcβ1 oraz NeuAc(α 2-3 lub α 2-6)Gal(β 1-4)GlcNAc β 1 [183].
Stężenie TSH w osoczu jest bardziej zależne od produkcji przysadkowej hormonu niż klirensu metabolicznego. W różnych chorobach tarczycy istnieje zależność między klirensem TSH a stężeniem trójjodotyroniny (T3) i tyroksyny (T4). Zmiany klirensu TSH są mniej nasilone i pojawiają się później niż produkcja hormonu. W sytuacji zwiększenia T3 i T4, w niedoczynności tarczycy, zahamowaniu ulega najpierw produkcja TSH w przysadce, obniża się stężenie TSH w surowicy, a w dalszej kolejności zmienia się klirens metaboliczny [184,185]. W eutyreozie klirens metaboliczny TSH wynosi około 25 ml/min/m2 i jest kilka razy mniejszy niż klirens poszczególnych podjednostek TSH
wynoszący odpowiednio 68 ml/min/m2 dla podjednostki α 48 ml/min/m2 dla
podjednostki β. W pierwotnej niedoczynności tarczycy klirens podjednostek jest mniejszy i wynosi 55 ml/min/m2 dla podjednostki α i 37 ml/min/m2 dla β. Nie
zaobserwowano zwiększonego klirensu poszczególnych podjednostek w nadczynności tarczycy [186]. Wskaźnik klirensu metabolicznego u pacjenta zależy od stanu metabolicznego organizmu i jest ściśle powiązany ze stężeniem T4 i T3. Wykazano korelację między klirensem kreatyniny i klirensem TSH. W niewydolności nerek klirens TSH jest mniejszy.
Hormon tyreotropowy poza regulacją aktywności białka NIS w komórkach tarczycy jest także symulatorem ekspresji czynników transkrypcyjnych TTF1 (ang. thyroid transcription factor-1), TTF2 (ang. thyroid transcription factor-2) oraz PAX8 (białka kodowanego przez gen “paired-box gene 8”) pobudzających ekspresję genów Tg, TPO, TSHR, NIS [90]. Tyreotropina zwiększa wychwyt jodu pobudzając wszystkie etapy metabolizmu jodków. Jest czynnikiem wzrostowym dla komórek tarczycy [187]. Dodatkowo w tarczycy stymuluje wychwyt glukozy i jej utlenianie. Wzrost wychwytu glukozy jest wynikiem zwiększonej ekspresji transportera glukozy typu 1 (GLUT1, ang.
glucose transporter 1) [188].
Działanie TSH na tarczycę odbywa się za pośrednictwem receptora błonowego związanego z regulatorowymi białkami G, znajdującego się w błonie podstawno-bocznej
31 komórek nabłonkowych gruczołu tarczowego. Gen TSHR zlokalizowany jest na chromosomie 14q31. Wytworzony receptor jest strukturą monomeryczną, której 75% podlega proteolizie tworząc formę dimeru. Obie formy podlegają działaniu TSH [180, 189]. Jest jedynym receptorem z grupy receptorów dla hormonów glikoproteinowych, w obrębie którego dochodzi do potranslacyjnej proteolizy i jedynym w tej grupie posiadającym właściwości immunogenne. Zbudowany jest z 764 reszt aminokwasowych, z których 20 wchodzi w skład peptydu sygnałowego, 395-397 tworzy część pozakomórkową N-końcową wiążącą ligand. Pozostałe reszty aminokwasowe budują 7 pętli przezbłonowych oraz cytoplazmtyczny koniec karboksylowy (tzw. domena C-końcowa). Forma aktywna receptora, powstająca na skutek połączenia liganda z TSHR, aktywuje białko G a następnie aktywowane są szlaki cAMP i fosfatydyloinozytolu [180,190,191]. Poza tarczycą TSHR wykryto w błonie adipocytów, fibroblastów, komórek mięśni okoruchowych, limfocytów, neuronów i astrocytów, komórek grasicy, przysadki, jąder, nerki, nadnercza, serca, kości. Gen TSHR znaleziono także w limfocytach T w jelitach [180,192,193].
2.1.8. Ludzki rekombinowany hormon tyreotropowy
Jednym z warunków skutecznego leczenia ZRT radiojodem jest uzyskanie odpowiednio wysokiego stężenia TSH. Alternatywą do endogennej stymulacji TSH niewymagającą kilkutygodniowego odstawienia LT4 jest podanie rhTSH. Ludzki rekombinowany TSH jest heterodimeryczną glikoproteiną będącą mieszaniną różnych wariantów glikozylacji rekombinowanego białka. Różni się podjednostką β od TSH. Zawiera wyższy odsetek silnie rozgałęzionych węglowodanów i nie ma grup siarczanowanych i N-acetylogalaktozaminy. Oligosacharydy wchodzące w skład rhTSH zakończone są NeuAc(α2-3)Gal (β1-4)GlcNAcβ1. Posiadając dużą ilość przyłączonych reszt kwasu sjalowego, rhTSH cechuje dłuższy okres półtrwania osoczu, mniejsze powinowactwo do TSHR, wyższa aktywność in vivo i niższy klirens metaboliczny [194,195]. Średnia zawartość reszt kwasu sjalowego przypadająca na 1 łańcuch
32 oligosacharydowy wynosi 1,9 w rhTSH w porównaniu do 0,4-0,5 w TSH [183, 196, 199] (Tabela 3).
Tabela 3. Zawartość reszt węglowodanowych przypadająca na łańcuch α i β rhTSH oraz
TSH
Fuc GalNAc GlcNAc Gal Man SA S04
rhTSH α 0,1 - 4,6 2,6 3,0 1,7 - β 2,2 - 4,7 2,9 3,0 2,3 - TSH α 0,4 1,3 4,0 0,8 3,0 0,4 0,9 β 1,7 1,6 3,9 0,6 3,0 0,4 1,1 Zmodyfikowano na podstawie: M.Szkudlinski, N.Thotakura, B.Weintraub. Subunit-specyfic functions of N-linked oligosaccharides in human thyrotropin: Role of terminal residues of α- and β-subunit oligosaccharides in metabolic clearance and bioactivity. Proc. Natl. Acad. Sci. USA 1995; Vol. 92: 9062-9066
Fukoza (Fuc), GalNAc (N-acetylogalaktozamina), GlcNAc (N-acetyloglukozamina) Gal (Galaktoza), Man (Mannoza), SA (Kwas sjalowy), SO4 (siarczany)
Wiążąc się z TSHR, rhTSH stymuluje wychwyt i przemianę jodu, wytwarzanie i wydzielanie Tg, T3 oraz T4 [194,196,197]. Wydalany jest głównie przez nerki, w mniejszym stopniu eliminowany jest przez wątrobę. Okres półtrwania rhTSH w organizmie wynosi 22 ± 9 godziny. Maksymalne stężenie po podaniu pojedynczej dawki osiąga po 13 ± 8 godzinach [189,196]. Zgodnie ze wskazaniami rejestracyjnymi rhTSH może być stosowany u pacjentów po tyreoidektomii, przed ablacją izotopem jodu 131I
resztkowej tkanki tarczycowej, u których nie uwidoczniono cech rozsianej choroby nowotworowej, w trakcie leczenia supresyjnymi dawkami L-tyroksyny z jednoczasowym oznaczeniem stężenia Tg i miana przeciwciał anty-Tg. Zaleca się podawanie aktywności izotopu jodu w przedziale od 30 mCi (1,1 GBq) do 100 mCi (3,7 GBq) [196,198,200]. Stosowanie aktywności powyżej 100mCi (3,7 GBq) w różnych ośrodkach na świecie wynika z doświadczeń własnych tych ośrodków w leczeniu ZRT oraz z indywidualnego rozpatrywania wskazań do terapii 131I u poszczególnych chorych. W dostępnych
publikacjach zakres podawanych jednorazowo aktywności 131I mieści się w przedziale
33 stosowania rhTSH są również badania kontrolne w przebiegu ZRT u pacjentów niskiego ryzyka, bez cech rozsianej choroby nowotworowej, w warunkach supresji TSH, z oznaczeniem Tg i anty-Tg. Dopuszcza się stosowanie rhTSH u pacjentów z przeciwwskazaniami do endogennej stymulacji TSH lub, u których takiej stymulacji nie udaje się uzyskać. Ludzki rekombinowany TSH stosowany jest w dwóch dawkach 0,9 mg, w iniekcjach domięśniowych, w odstępach 24-godzinnych. Nie ma konieczności modyfikacji dawki u osób w wieku podeszłym [196]. W grupie pacjentów ze schyłkową niewydolnością nerek leczonych dializoterapią, po podaniu rhTSH, zaobserwowano wydłużone o kilka dni zwiększone stężenie TSH w porównaniu z grupą pacjentów bez zaburzeń funkcji nerek [196, 204]. W warunkach eutyreozy po podaniu rhTSH występuje większy klirens nerkowy 131I i tym samym krótszy efektywny okres półtrwania radiojodu
w osoczu. Dawka pochłonięta we krwi po podaniu radiojodu oraz ekspozycja tkanek na promieniowanie są więc mniejsze [205,206,207,208]. Przeciwwskazaniem do podawania rhTSH są ciąża i nadwrażliwość na bydlęcy lub ludzki hormon tyreotropowy lub jakąkolwiek substancję pomocniczą. Do najczęściej opisywanych działań niepożądanych rhTSH należą nudności i bóle głowy (odpowiednio 12% i 7%), rzadziej zawroty głowy, parestezje, wymioty, biegunka, zmęczenie, osłabienie. Pozostałe działania niepożądane występują rzadko [194, 196] (Tabela 4).
34
Tabela 4. Działania niepożądane po zastosowaniu rhTSH u chorego ze ZRT. Żródło:
Product Monograph Pr THYROGEN® Thyrotropin alfa for injection. Genzyme Canada Inc. Date of Authorization: August 28, 2009:28
Częstotliwość działań niepożądanych rhTSH
Bardzo często
≥1/10 nudności 12%
Często
≥1/100 do<1/10
ból głowy 7%, zmęczenie, osłabienie, wymioty, biegunka, zawroty głowy, parestezje
Niezbyt często ≥1/1000 do <1/100
uczucie gorąca, pokrzywka, wysypka, objawy grypopodobne, dreszcze, gorączka, ból pleców
Częstość nieokreślona
obrzęk guza, ból w miejscu przerzutów, drżenie, udar, kołatanie serca, zaczerwienienie, duszność, świąd, nadmierne pocenie, bóle stawów, bóle mięśni, dyskomfort, ból, świąd, wysypka oraz pokrzywka w miejscu wstrzyknięcia domięśniowego, zmniejszenie stężenie TSH
Brak objawów niedoczynności tarczycy lub pojawienie się objawów o niewielkim nasileniu po zastosowaniu rhTSH, w porównianiu z 4-6 tygodniowym okresem odstawienia L-tyroksyny, może zapewnić pacjentowi lepszą jakość życia przed hospitalizacją oraz szybszy powrót do aktywności zawodowej po okresie hospitalizacji [209, 210].
W nielicznych dotychczasowych publikacjach wykazano, że rhTSH stymuluje wytwarzanie Tg u chorych z obecnymi przerzutami ZRT [211, 212]. Nie odnotowano wpływu rhTSH lub stwierdzono jego niewielki wpływ na wzrost tkanki guza