wieloatomowe - hybrydyzacja
Czy w oparciu o koncepcję
orbitali molekularnych
można wytłumaczyć
budowę cząsteczek?
Koncepcja
OA OA OC OA hyb OA OA hyb OA hyb OC OA – orbitale atomoweOA hyb – orbitale atomowe zhybrydyzowan OM – orbitale molekularne
Fakty doświadczalne
153 n-C6H14 C-C 154 CH3CH(OH)CH3 C-C 154 C3H8 C-C 155 C2H5OH C-C 154 C2H6 C-C 154 diament C-C 96 HCOOH O-H 96 CH3OH O-H 97 H2O2 O-H 96 H2O O-H 97 OH -O-H Długość wiązania [pm] Cząsteczka WiązanieFakty doświadczalne
z
Jak wyjaśnić kątową
budowę cząsteczki
wody?
z
Jak wyjaśnić strukturę
diamentu?
H O 2δ− δ+ δ+ 105° H 10_229 Diamond (a) 109.5o
Co to jest hybrydyzacja?
Jakie są rodzaje hybrydyzacji?
Jak w oparciu o hybrydyzację wyjaśnić
strukturę molekuł?
Hybrydyzacja
z y z x y x x y z y x sp3 sp3 sp3 sp3 Hybridization gives a tetrahedral arrangement s py px pz x y z z y x y z x y z z xsp
32p
2s
hybrydyzacja
sp
3Hybrydyzacja
sp
3 Węgiel CHybrydyzacja
sp
3 H H H H sp3 sp3 sp3C
Wizualizacja cząsteczek Czasteczka_hybryd_sp3.MOVC
H
H
H
H
C
H
H
H
H
Hybrydyzacja
Obital sp3Hybrydyzacja
C sp3 sp3 sp3 sp3 H1s H1s H1s H1ssp
3 Metan CH4H H H H
C
H
H
H
H
Hybrydyzacja
sp
3 Metan CH4 09_162 sp3 sp3 H1s H1s H1s lone pair N sp3 sp3Hybrydyzacja
sp
3 Amoniak NH3Hybrydyzacja
CH
4NH
3H
2O
tetraedr 109o silniejsze odpychanie słabsze odpychanie kąt ↑ kąt ↓ piramida trygonalna 107o kątowa 105oAlkany
Hybrydyzacja
sp
3Węglowodory nasycone
n-alkany = łańcuchy „proste”
n-oktan izomeria łańcuchowa izooktan sp3 109°28’ 109°28’ sp3 109°28’ 109°28’
22_500 Boat These two H atoms repel each other Chair
Hybrydyzacja
sp
3Węglowodory nasycone cykliczne
Cykloheksan - konformacje
Hybrydyzacja
sp
3 Etan C2H6 22_502 H H H H H H C CHybrydyzacja
„płaszczyzna wiązania” konformery 1,2-dichloretanu Rotacja He 1.0 1.1 1.2 1.3 1.4 1.5 1.6 1.7 0.5 1 1.5 2 2.5 3 rotacja en e rg ia p o ten cj al n a 3 kcal/molHybrydyzacja
sp
3 RotacjaHybrydyzacja
sp
2hybrydyzacja
2p 2s sp2Hybrydyzacja
sp
2 09_165sp
2orbital
p orbital
sp
2orbital
sp
2orbital
orbital Czasteczka_hybryd_sp2.MOVHybrydyzacja
C C sp2 sp2 sp2 sp2 H1 s H1 s H1s H1s sp2 sp2 Eten C2H4Hybrydyzacja
sp
2 Eten C2H4 09_168 (b)H
C
C
H
H
H
sp2 sp2 sp2 sp2 H1s H1s C C 2p sp2 sp2 (a)Hybrydyzacja
sp
2 Benzen C6H6 09_202 H H H sp2 C C C C C C sp2 H1s H H HHybrydyzacja
sp
2 Benzen C6H6 H H H H H H H H H H H H wiązanie zdelokalizowane typu πHybrydyzacja
Czasteczka_NO3.MOVHybrydyzacja
sp
z s px y y x z z y gives a linear arrangement x y z Hybridization 180° x x x y z Czasteczka_hybryd_sp.MOVHybrydyzacja
O C O
sigm a bond
(1 pair of electrons) pi bond (1 pair of electrons) pi bond (1 pair of electrons) (a)
O
C
O
sp
CO2Hybrydyzacja
p sp sp p ( ) Nsp
N2lone pair sigma bond lone pair N N sp sp sp sp (c) N N
2p 2p H1s H sp 2p 2p C sp 2p 2p 2p C H H1s 2p sp
Hybrydyzacja
Acetylen C2H2Porównanie typów hybrydyzacji
Jak z orbitali atomowych otrzymać orbitale hybrydowe?
sp2 ) ( ) ( 2 1 2 2 1 1 x x p s t p s t − = + = x y x y x p p s t p p s t p s t 6 1 2 1 3 1 3 6 1 2 1 3 1 2 3 2 3 1 1 − + = − − = + = ) ( ) ( ) ( ) ( 2 1 4 2 1 3 2 1 2 2 1 1 z y x z y x z y x z y x p p p s t p p p s t p p p s t p p p s t + + + = + − − = − + − = − − + =
Formalizm – liniowa kombinacja orbitali atomowych sp
“p” charakter
“s” charakter
sp
3sp
2sp
gęstość
elektronowa
Porównanie typów hybrydyzacji
Porównanie typów hybrydyzacji
wzrost charakteru „s”
i 2 p-p
HC≡CH
828
12.1
sp-sp
C≡C
CH
2=CH
2607
13.4
sp
2-sp
2C=C
CH
3- CH
3368
15.4
sp
3-sp
3C-C
molekuła
energia
długość,
pm
typ
wiązanie
i p-p
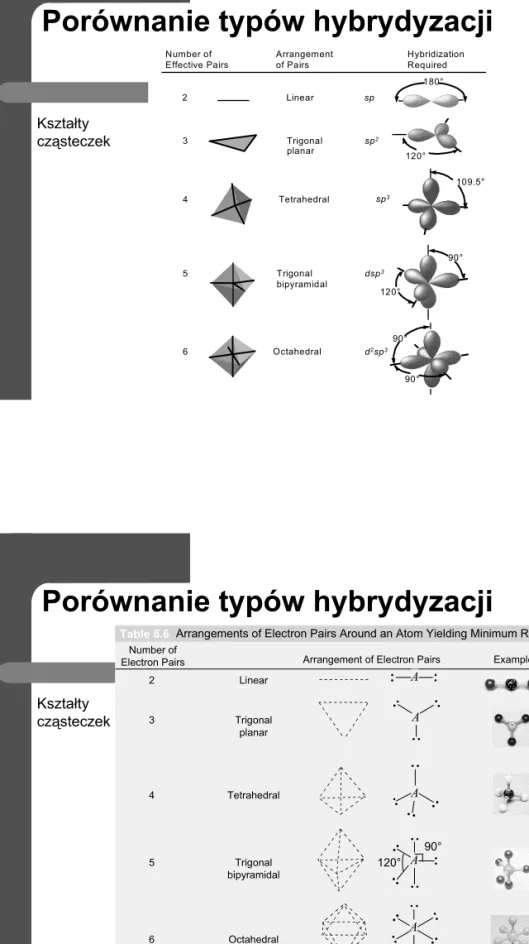
Number of Effective Pairs Arrangement of Pairs Hybridization Required 2 Linear sp 180° 3 Trigonal planar sp2 120° 4 Tetrahedral 109.5° 5 Trigonal bipyramidal dsp 3 90° 120° 90° 90° 6 Octahedral d2sp3 sp3 Kształty cząsteczek
Porównanie typów hybrydyzacji
08_06T
Number of Electron Pairs
Table 8.6Arrangements of Electron Pairs Around an Atom Yielding Minimum Repulsion Arrangement of Electron Pairs Example
2 Linear 3 Trigonal planar 4 Tetrahedral 5 Trigonal bipyramidal 6 Octahedral A A A A 120° 90° A Kształty cząsteczek
Porównanie typów hybrydyzacji
Przykłady cząsteczek 105o H2O kątowy 2 2 sp3 107o NH3 piiramida trygonalna 1 3 sp3 109o CH4 tetraedr 0 4 sp3 SO2 kątowy 1 2 sp2 120o SO3 trójkąt płaski 0 3 sp2 kąt pomiędzy wiązaniami przykład kształt liczba wolnych par liczba podstawników hybrydyzacjaOrbitale molekularne
Czy hybrydyzacja jest potrzebna do opisu wiązań w
cząsteczce?
Cząsteczka CO – bez hybrydyzacji 2s 2s σs σ* s
2p
2p
σ
pπ
pπ
* pσ
* pC
O
2p
2p
σ
pπ
pπ
* pσ
* p2p
2p
σ
pπ
pπ
* pσ
* pC
O
Bielański
Orbitale molekularne
Cząsteczka CO –hybrydyzacja atomu C
2p 2px σt1-p πp π* p σ* ti-p 2s σns t1 t2 2py 2pz t2 2s 2p 2px σt1-p πp π* p σ* ti-p 2s σns