KLINIKA KARDIOCHIRURGII I TRANSPLANTOLOGII
KATEDRY KARDIO-TORAKOCHIRURGII
UNIWERSYTETU MEDYCZNEGO IM. KAROLA MARCINKOWSKIEGO
W POZNANIUSebastian Stefaniak
W
PŁYW ZABIEGÓWBEZPOŚREDNIEJ REWASKULARYZACJI MIĘŚNIA SERCOWEGO
NA ZMIANĘ FUNKCJI SKURCZOWEJ LEWEJ KOMORY
U CHORYCH Z OBNIŻONĄ FRAKCJĄ WYRZUTOWĄ
ROZPRAWA DOKTORSKA
Promotor: Prof. dr hab. med. Marek Jemielity
Nec temere, nec timide
Moim najbliższym…S
PIS TREŚCISPIS TREŚCI 3
SKRÓTY UŻYTE W PRACY: 5
1. WSTĘP: 7
1.1„HISTORIA MAGISTRA VITAE EST” CZYLI KRÓTKIE SŁOWO O HISTORII 8
1.1.1CHOROBA NIEDOKRWIENNA SERCA 8
1.1.2HISTORIA ROZWOJU LECZENIA CHIRURGICZNEGO CHOROBY NIEDOKRWIENNEJ SERCA 8 1.1.3ROZWÓJ DIAGNOSTYKI OBRAZOWEJ NACZYŃ WIEŃCOWYCH ORAZ OCENY FUNKCJI I PERFUZJI
MIOKARDIUM W CHOROBIE NIEDOKRWIENNEJ SERCA 10
1.1.4FUNKCJA MIĘŚNIA SERCOWEGO I JEGO PERFUZJA W BADANIACH HISTORYCZNYCH 11 1.2NON INTELLECTI NULLA EST CURATIO MORBI…PATOFIZJOLOGIA NIEWYDOLNOŚCI SERCA W
PRZEBIEGU CHOROBY NIEDOKRWIENNEJ. 12
1.2.1ZABURZENIA KURCZLIWOŚCI MIĘŚNIA SERCOWEGO W NIEDOKRWIENIU 12
1.2.2NIEDOKRWIENIE SPOCZYNKOWE I WYSIŁKOWE 13
1.2.2.1 Niedokrwienie spoczynkowe 13 1.2.2.2 Niedokrwienie wysiłkowe 14 1.2.3OGŁUSZENIE MIOKARDIUM 16 1.2.3.1 Ogłuszenie ostre 16 1.2.3.2 Ogłuszenie przewlekłe 17 1.2.4HIBERNUJĄCE MIOKARDIUM 18 1.2.4.1 Hibernacja ostra 18 1.2.4.2HIBERNACJA PRZEWLEKŁA 19
1.2.5ZAWAŁ MIĘŚNIA SERCOWEGO 22
2. CEL BADANIA 25
2.1.WPROWADZENIE - ZAPLANOWANIE BADANIA 25
2.2CELE BADANIA 26
3. MATERIAŁ I METODY 27
3.1ZGODA NA PRZEPROWADZENIE I FINANSOWANIE BADANIA 27
3.2KRYTERIA KWALIFIKACJI ORAZ WYŁĄCZENIA Z BADANIA. 27
3.3PROCEDURA ZABIEGU OPERACYJNEGO 28
3.4CHARAKTERYSTYKA GRUPY BADANEJ 30
3.5BADANIA PRZEDOPERACYJNE 32
3.5.1BADANIE ECHOKARDIOGRAFICZNE 32
3.5.2OBRAZOWANIE METODĄ REZONANSU MAGNETYCZNEGO 32
3.6BADANIA ŚRÓDOPERACYJNE 39
3.6.1ŚRÓDOPERACYJNA OCENA PRZEPŁYWU PRZEZ WSZCZEPIONE POMOSTY 39
3.7BADANIA POOPERACYJNE 40
3.7.1BADANIE REZONANSU MAGNETYCZNEGO SERCA 40
3.7.2TOMOGRAFIA KOMPUTEROWA SERCA 41
3.8ZŁOŻONY KLINICZNY PUNKT KOŃCOWY 41
3.9PRZYGOTOWANIE DANYCH DO ANALIZY 43
3.10ANALIZA STATYSTYCZNA WYNIKÓW 43
4. WYNIKI 45
4.1ZŁOŻONY KLINICZNY PUNKT KOŃCOWY 45
4.1.1ŚMIERTELNOŚĆ 45
4.1.3DOKONANY UDAR OŚRODKOWEGO UKŁADU NERWOWEGO 45
4.2WYNIKI ANALIZY BADAŃ REZONANSU MAGNETYCZNEGO 46
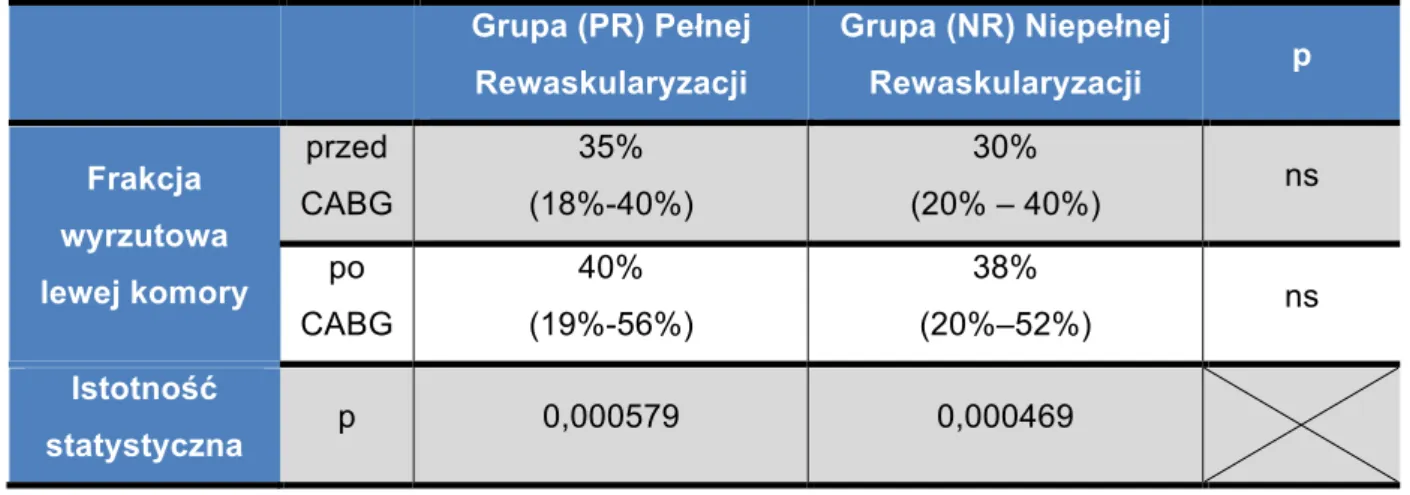
4.2.1OCENA FUNKCJI SKURCZOWEJ LEWEJ KOMORY U PACJENTÓW Z OBNIŻONĄ FRAKCJĄ
WYRZUTOWĄ PRZED I PO ZABIEGU BEZPOŚREDNIEJ REWASKULARYZACJI MIĘŚNIA SERCOWEGO NA PODSTAWIE ZMIANY LVEF I KURCZLIWOŚCI POSZCZEGÓLNYCH SEGMENTÓW 46
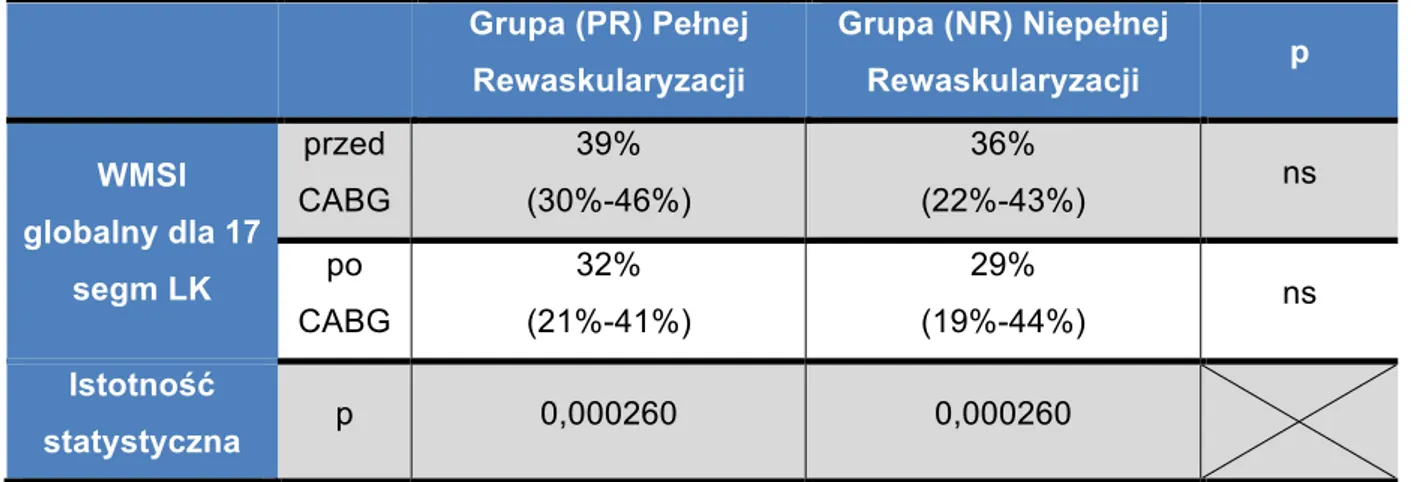
4.2.2WPŁYW BEZPOŚREDNIEJ REWASKULARYZACJI MIĘŚNIA SERCOWEGO NA POPRAWĘ
KURCZLIWOŚCI SEGMENTARNEJ W ZALEŻNOŚCI OD GRUBOŚCI ŻYWOTNEGO MIOKARDIUM 53 4.2.3WPŁYW BEZPOŚREDNIEJ REWASKULARYZACJI MIĘŚNIA SERCOWEGO NA ZMIANĘ
KURCZLIWOŚCI W SEGMENTACH HIBERNOWANYCH I OGŁUSZONYCH MIĘŚNIA LEWEJ KOMORY 57
4.3OCENA WYKONANYCH POMOSTÓW OMIJAJĄCYCH 58
4.3.1OCENA WSZCZEPIONYCH POMOSTÓW WIEŃCOWYCH 60
5. OMÓWIENIE WYNIKÓW I DYSKUSJA 65
5.1OCENA WYNIKÓW 65
5.1.1WPŁYW BEZPOŚREDNIEJ REWASKULARYZACJI MIĘŚNIA SERCOWEGO NA ZMIANĘ FUNKCJI
SKURCZOWEJ MIĘŚNIA LEWEJ KOMORY 65
5.1.2ŻYWOTNOŚĆ MIĘŚNIA SERCOWEGO ORAZ WYSTĘPOWANIE STANU HIBERNACJI I OGŁUSZENIA
67
5.1.3WYSTĄPIENIE ZŁOŻONEGO KLINICZNEGO PUNKTU KOŃCOWEGO, CZY TECHNIKA OPERACJI MA
ZNACZENIE? 69
5.1.4OCENA DROŻNOŚCI POMOSTÓW W OBSERWACJI KOŃCOWEJ 70
5.2WYBÓR METODY DIAGNOSTYCZNEJ OCENY PERFUZJI MIOKARDIUM ORAZ JEGO ŻYWOTNOŚCI
72
5.3INNE NIŻ BEZPOŚREDNIA REWASKULARYZACJA METODY POPRAWY FUNKCJI MIOKARDIUM U PACJENTÓW Z POZAWAŁOWYM USZKODZENIEM FUNKCJI LEWEJ KOMORY 77
5.4PACJENCI Z LEWOKOMOROWĄ NIEWYDOLNOŚCIĄ MIEŚNIA SERCOWEGO 80
5.4.1ŻYWOTNOŚĆ MIOKARDIUM 80
5.4.2PRZEBIEG ZMIAN W MIOKARDIUM W IZOLOWANEJ CHOROBIE NIEDOKRWIENNEJ SERCA 81
5.4.3CHORZY W BADANEJ GRUPIE 82
5.4.5TRUDNOŚCI W DIAGNOSTYCE U CHORYCH Z GRUPY WŁĄCZONEJ DO BADANIA 84
5.5PODSUMOWANIE 85
6. WNIOSKI 87
7. ZAŁĄCZNIKI 88
7.1STRESZCZENIE W JĘZYKU POLSKIM 88
7.2STRESZCZENIE W JĘZYKU ANGIELSKIM 91
7.3SPIS TABEL 94
7.4SPIS RYCIN 95
7.5ZGODA KOMISJI BIOETYCZNEJ 97
7.6ZGODA CHOREGO 98
7.7INFORMACJA DLA CHOREGO 99
SKRÓTY UŻYTE W PRACY:
ATP ang. Adenosine TriPhosphate pol. adenozynotrifosforan
ACT ang. Activated Clotting Time pol. aktywowany czas krzepnięcia
AHA ang. American Heart Association
pol. Amerykańskie Towarzystwo Kardiologiczne BIS ang. BISpectral index
pol. indeks bispektralny BMI ang. Body Mass Index pol. indeks masy ciała
CABG ang. Coronary Artery Bypass Graft pol. pomostowanie aortalno-‐wieńcowe CAD ang. Coronary Artery Disease
pol. choroba wieńcowa CFR ang. Coronary Flow Reserve
pol. rezerwa wieńcowa
CKMB ang. Creatine Kinase Myocardial Band pol. frakcja miokardialna (izoenzym) kinazy kreatynowej CrP CMR ang. Cardiac Magnetic Rezonans
pol. Rezonans Magnetyczny Serca CR ang. Contractile Reserve
pol. rezerwa kurczliwości CrP ang. creatine phosphate pol. kinaza kreatynowa CT ang. Computer Tomography pol. tomografia komputerowa
CCS ang. Canadian Cardiovascular Society
pol. Kanadyjskie Towarzystwo Kardiologiczno-‐Naczyniowe EACTS ang. European Association of Cardio-‐Thoracics Surgeons pol. Europejskie Towarzystwo Kardio-‐Torakochirurgii EBM ang. Evidence Based Medicine
pol. medycyna oparta na faktach ECC ang. ExtraCorporeal Circulation
pol. krążenie pozaustrojowe ECHO ang. ECHOcardiography
pol. echokardiografia
EEG ang. ElectroEncephaloGraphy pol. elektroencefalografia ECG/EKG ang. ElectroCardioGraphy
pol. elektrokardiografia
ESC ang. European Association of Cardiology pol. Europejskie Towarzystwo Kardiologii IABP ang. Intra-‐Aortic Ballon Pump
pol. kontrapulsacja (balonowa) wewnątrzaortalna IPSC ang. Induced Pluripotent Stem Cells
pol. indukowane pluripotencjalne komórki macierzyste ITA ang. Internal Thoracic Artery
pol. tętnica piersiowa wewnętrzna LAD ang. Left Anterior Descending
pol. tętnica zstępująca przednia (naczynie wieńcowe) LIMA ang. Left Internal Mammary Artery
pol. tętnica piersiowa wewnętrzna lewa LVEF ang. Left Ventricular Ejection Fraction
pol. frakcja wyrzutowa lewej komory LVH ang. Left Ventricular Hypertrophy pol. przerost lewej komory
MAP ang. Mean Arterial Pressure pol średnie ciśnienie tętnicze
MIDCAB ang. Minimal Invasive Direct Coronary Artery Bypass pol. pomostowanie wieńcowe z dostępu małoinwazyjnego BR/OB ang. Biernacki Reaction
pol. odczyn Biernackiego
OPCAB ang. Off Pump Coronary Artery Bypass
pol. pomostowanie wieńcowe bez użycia krążenia pozaustrojowego PERF ang. PERFusion
pol. perfuzja
PET ang. Positron Emission Tomography pol. pozytronowa tomografia emisyjna
PET-‐CT ang. Positron Emission Tomography–Computed Tomography
pol. hybrydowy aparat pozytronowej tomografii emisyjnej i tomografii komputerowej
RA ang. Radial Artery
pol. Tętnica promieniowa
RIMA ang. Right Internal Mammary Artery pol. tętnica piersiowa wewnętrzna prawa SVB ang. Surgical Ventricular Reconstruction pol. chirurgiczne rekonstrukcja komory SVBG ang. Saphenous Vein Bypass Graft
pol. Pomost aortalno-‐wieńcowy z żyły odpiszczelowej SPECT ang. Single Photon Emission Computed Tomography pol. tomografia emisyjna pojedyńczych fotonów TIA ang. Transient Ischemic Attack
pol. przemijający atak niedokrwienia
WMSI ang. Wall Motion Score Index
1.
W
STĘP:
W dzisiejszych czasach niewydolność serca jest najczęstszą przyczyną hospitalizacji po 65 roku życia oraz zgonu w krajach rozwiniętych i rozwijających się. Raport Amerykańskiego Towarzystwa Kardiologicznego1, wskazuje że chorzy na niewydolność serca w samych Stanach Zjednoczonych Ameryki w 2012 roku pochłonęli budżet w wysokości 31 bilionów dolarów przy 5 milionach chorych.
Według obecnych danych Europejskiego Towarzystwa Kardiologicznego2 jest to odsetek pacjentów, który od wielu lat stanowi największe wyzwanie medycyny w krajach nowoczesnego świata, pomimo iż nie oszacowano dokładnych danych statystycznych, które wyodrębniłyby koszty leczenia niewydolności od ogólnej statystyki chorób serca.
Niewydolność serca w sposób zdecydowany obniża standard życia chorego oraz negatywnie wpływa na sposób postrzegania zarówno otoczenia, jak i siebie samego. Taki obraz spotykany w codziennej praktyce klinicznej lekarza uświadamia nam jak mocno choroba ta wpływa na codzienne życie wszystkich ludzi. Dwadzieścia procent osób dotkniętych chorobami serca ma współistniejącą depresję. Natomiast w przypadku niewydolności serca, odsetek ten wzrasta do 77,5%!3 , 4 Jest to więc
schorzenie, które jak mawiali starożytni grecy, dotyka „soma”, „psyche” i „polis”. Obecnie leczenie niewydolności mięśnia sercowego staje się priorytetem medycyny, a możliwość poprawy jego funkcji nieocenioną korzyścią dla pacjenta i społeczeństwa.
1.1 „Historia magistra vitae est” czyli krótkie słowo o historii 1.1.1 Choroba niedokrwienna serca
Pierwszy opis choroby, nienazywanej ówcześnie po imieniu i nie kojarzonej z sercem, pochodzi ze starożytnego papirusa Ebersa5 datowanego na ok. 1500 lat
p.n.e. Łączono ją wtedy z dolegliwościami żołądka. W 2009 roku na corocznym kongresie AHA, przedstawiono dowody na istnienie miażdżycy u mumii sprzed 3500 lat. 6 Dokładnie opisano mumię faraona Merenptah, zgon datowany na 1203 p.n.e z obrazem CT odpowiadającym miażdżycy naczyń.
Pierwsze dokładniejsze opisy choroby niedokrwiennej serca spotykamy w dziełach Hipokratesa. W czasach nowożytnych zapiski wskazują na badania naczyń wieńcowych przez L. da Vinci, jednak to W. Harvey – nadworny lekarz króla Karola I jako pierwszy w 1628 opisał układ krążenia człowieka. Dopiero ponad 100 lat później od odkrycia W. Harvey`a, w 1761r G.B. Morgagni w swojej pracy użył sformułowania "skleroza naczyń wieńcowych".7
Kluczowe dzieło autorstwa W. Heberden`a traktujące o objawach „angina pectoris” powstało w 1772 i nie było wiązane przez autora z wcześniejszymi odkryciami B. Morgagni`ego. Przełom nastąpił w 1809 roku, gdy po raz pierwszy objawy choroby niedokrwiennej i miażdżycy połączył J. Burns. Kolejne sto lat później w 1912 opisano morfologię zawału (J.B. Herrick) 8 , a jego kryteria
elektrokardiograficzne opisali w 1918r. G. Bousfield9 i w 1921 F. A. Willius.10
W Polsce pierwszy opis dusznicy bolesnej pochodzi z 1812, kiedy na Uniwersytecie Wileńskim przedstawiono rozprawę doktorską J. Chrzczonowicza „De angore pectoris” .11,12
1.1.2 Historia rozwoju leczenia chirurgicznego choroby niedokrwiennej serca
Początki leczenia chirurgicznego mającego ulżyć w dolegliwościach bólowych pochodzących od serca datowane są na 1916 rok, gdy Belgijski chirurg E. Jonessco dokonał sympatektomii szyjnej celem zniesienia bólu wieńcowego. 13 Było to
następstwo opublikowanej w 1899 roku sugestii Francois-Franck, że zabieg tego typu powinien dać ulgę w dolegliwościach wieńcowych. Pozytywny efekt tego
zabiegu spowodował, że metoda ta z modyfikacjami była w powszechnym użyciu aż do lat 30 ubiegłego stulecia. Powyższy fakt może dziwić przy braku podstaw patofizjologicznych takiego działania. W ówczesnym czasie zapisano również próby tyreidectomii, które zarzucono po licznych powikłaniach i objawach ubocznych.14
W 1952 roku opublikowano pracę A. Vineberga, w której opisywał on pierwsze rewaskularyzacje pośrednie mięśnia sercowego wykonane poprzez wszczepienie wolnego końca lewej tętnicy piersiowej wewnętrznej w mięsień sercowy. Dziesięć lat od publikacji A. Vineberga, D.C. Sabiston dokonał pierwszej rewaskularyzacji bezpośredniej mięśnia sercowego wszczepiając żyłę odpiszczelową do prawej tętnicy wieńcowej. Była to reoperacja pacjenta, u którego rok wcześniej wykonał endarektomię prawej tętnicy wieńcowej.15
W tym historycznym opisie nie sposób też pominąć pierwszego zastosowania tętnicy piersiowej wewnętrznej do bezpośredniej rewaskularyzacji mięśnia sercowego przez Rosjanina V.I. Kolesowa w 1963 roku, a przedstawionego na konferencji w Leningradzie oraz żylnej rewaskularyzacji lewej tętnicy wieńcowej wykonanej rok póżniej w 1964 przez zespół złożony z H.E. Garretta, E.W. Dennisa i M.E. De Bakey’a celem odłączenia chorego od krążenia pozaustrojowego.16
W tym szacownym gronie zapisał się ponadto R. Favaloro17, który w 1968
roku wykonał kilka pomostów wieńcowych i jako pierwszy połączył zastosowanie uszypułowanej tętnicy piersiowej wewnętrznej wraz z wolnymi graftami żylnymi. Od tamtej pory nastąpił dynamiczny rozwój bezpośredniej rewaskularyzacji mięśnia sercowego, który trwa do dnia dzisiejszego, osiągając niejednokrotnie status najczęściej wykonywanego, planowanego zabiegu operacyjnego na świecie.
Nie sposób też pominąć Polskiej historii leczenia choroby niedokrwiennej serca. Pierwszy zabieg cewnikowania serca w Polsce wykonał Jan Moll w Poznaniu w 1957r i jemu też przypisuje się pierwszą bezpośrednią rewaskularyzację mięśnia sercowego przeprowadzoną w Łodzi w 1970r. R. Jaszewski jako pierwszy użył tętnicy piersiowej wewnętrznej w 1982r, zaś M. Zembala dwa lata później użył obu tętnic piersiowych wewnętrznych jako graftów do bezpośredniej rewaskularyzacji mięśnia sercowego.18
1.1.3 Rozwój diagnostyki obrazowej naczyń wieńcowych oraz oceny funkcji i perfuzji miokardium w chorobie niedokrwiennej serca
Kiedy w 1962 roku F.M. Sones19 opisał technikę cewnikowania serca i
koronarografii, chirurdzy uzyskali dostęp do doskonałego narzędzia umożliwiającego planowanie zabiegu operacyjnego. Badanie koronarograficzne do dnia dzisiejszego w udoskonalonej formie, jest nadal, pomimo dynamicznego rozwoju tomografii komputerowej i rezonansu magnetycznego, złotym standardem oceny naczyń wieńcowych. Komputerowa tomografia naczyń wieńcowych nadal nie osiągnęła swoistości, umożliwiającej traktowania jej badań jako podstawy do interwencji inwazyjnej, zaś badania Rezonansu Magnetycznego pomimo nowoczesnych aparatów 3-Teslowych do tej pory charakteryzują się dość niską rozdzielczością przestrzenną, uniemożliwiającą dokładną ocenę naczyń wieńcowych.20
Niemalże równocześnie dokonano pierwszej obrazowej oceny funkcji serca w 1963 roku. C.R. Joyner i J.M. Reid z Uniwersytetu Pensylwanii wykonali pierwsze ultrasonograficzne badanie serca z użyciem techniki jednowymiarowej. Zaledwie 7 lat później udoskonalono obrazowanie ultrasonograficzne uzyskując pierwsze badania dwuwymiarowe, a w 1977 roku wprowadzono głowice sektorowe z odchylaniem wiązku ultradźwiękowej, co dało początek technice dopplerowskiej oceny przepływu.21
W czasie rozwoju ultrasonografii, jedynym dostępnym badaniem obrazowym wskazującym na możliwe zaburzenia funkcji mięśnia lewej komory była wentrykulografia, wykonywana podczas cewnikowania serca. Umożliwiała ona ocenę kurczliwości oraz pośrednich wskaźników angiograficznych w tym m.in. frakcji wyrzutowej (EF).22
Na tym polu jedną z najmłodszych metod oceny obrazowej i funkcjonalnej serca jest rezonans magnetyczny. Pierwsze obrazy kardiologiczne bramkowane sygnałem EKG uzyskał P. Lauterbura w 1983r. Skanery rezonansu udoskonalane poprzez zwiększenie natężenia pola magnetycznego, skrócenie czasu rejestracji sygnału, odpowiednie bramkowanie i zastosowanie środków kontrastowych znajdują zastosowanie diagnostyczne od około 10 lat.23
1.1.4 Funkcja mięśnia sercowego i jego perfuzja w badaniach historycznych
W 1698 roku P. Chirac wywołał zatrzymanie pracy serca u psa podwiązując jego tętnicę wieńcową.24 W swojej pracy nie przeoczył zależności pomiędzy
zamknięciem tętnicy wieńcowej, a zmianą kurczliwości mięśnia sercowego. Jednakże pierwsze kompleksowe badania nad perfuzją i funkcją mięśnia sercowego rozpoczeli swoimi doświadczeniami T. Tennant i CJ. Wiggers, opublikowanymi w 1935 roku.25 Opisali oni zaburzenia kurczliwości mięśnia sercowego w trakcie
60-sekundowego zamknięcia tętnicy wieńcowej oraz ich ustąpienie po przywróceniu krążenia. Ich następcami był zespół Blumgart’a, który w 1941 roku stwierdził wystąpienie martwicy po 20 minutach niedokrwienia mięśnia sercowego z uwolnieniem enzymów i nieodwracalnym uszkodzeniem miokardium pomimo przywrócenia normalnego przepływu krwi.26
Wyżej cytowana praca wysunęła hipotezę o odwracalnym i nieodwracalnym niedokrwieniu mięśnia sercowego, która do końca lat 70 była uznawana za obowiązującą. Jako odwracalne niedokrwienie uznano krótkotrwałe upośledzenie funkcji miokardium, które ustępuje po przywróceniu prawidłowego przepływu krwi i nie wykazuje cech strukturalnego uszkodzenia komórek. Jako nieodwracalne uszkodzenie miokardium uznano brak powrotu funkcji po przywróceniu przepływu.
Powyższe tezy podważyły obserwacje K.S. Heyndrickx’a opublikowane 1978 roku. Opisał on ustępowanie zaburzeń kurczliwości po kilku dniach od niedokrwienia trwającego poniżej 20 minut.27 To zjawisko dopiero w 1982 roku E. Braunwald i R.A.
Kloner określili mianem ogłuszonego miokardium z ang. „stunned myocardium”.28
Kiedy definicja ogłuszenia miokardium weszła do codziennego użycia, zauważono także stan, w którym pomimo długotrwałego utrzymywania się niedokrwienia, nie doszło do martwicy komórek, a dopiero przywrócenie wystarczającego przepływu krwi spowodowało powrót funkcji mięśnia. Ten stan zyskał nazwę hibernującego miokardium z ang. „Hibernating myocardium”29, a jego
autor S. Rahimtoola opublikował również przypadek chorego, poddanego zabiegowi bezpośredniej rewaskularyzacji mięśnia sercowego, u którego wykazał poprawę frakcji wyrzutowej lewej komory z 37% przedoperacyjnie do 78% pooperacyjnie po 8 miesiącach30.
Kolejne lata to liczne prace szukające podstaw biochemicznych i doświadczeń opisujących procesy zachodzące w mięśniach pod wpływem niedokrwienia.
Przez 3 kolejne dekady zidentyfikowano wiele fenomenów, które spełniają
funkcje obronne przed zawałem i powracającym niedokrwieniem31. Do ogłuszenia
oraz hibernacji, dołączyło hartowanie niedokrwieniem - ostre (ischaemic preconditioning), jak też opóźnione (SWOP – second window of preconditioning), hartowanie reperfuzją (ischemic postconditioning) oraz na odległość (remote
ischaemic preconditioning)31, 32. Wszystkie powyższe stany do dnia dzisiejszego
zajmują trwałe miejsce w badaniach w laboratoriach i klinikach na całym świecie.
1.2 Non intellecti nulla est curatio morbi… Patofizjologia niewydolności serca w przebiegu choroby niedokrwiennej.
1.2.1 Zaburzenia kurczliwości mięśnia sercowego w niedokrwieniu
W każdej postaci niedokrwienia pojawiają się zaburzenia kurczliwości miokardium. Na wystąpienie tego zjawiska potrzeba niekiedy tylko kilka sekund. Jest to mechanizm obronny, w której komórki nie wykonują silnie energochłonnego skurczu, przez co oszczędzają energię zmagazynowaną w ATP na podstawowe procesy życiowe. Charakter późniejszych zmian, zależy od wielu czynników występujących w procesie niedokrwienia.
W przypadku znacznie ograniczonej perfuzji spoczynkowej >50% funkcja skurczowa ustaje. Wewnątrzkomórkowe zasoby ATP i CrP szybko ulegają wyczerpaniu i dochodzi do stopniowej nekrozy lub apoptozy w zależności od strefy zawałowej.31,32,34
W przypadku umiarkowanie ograniczonej spoczynkowej perfuzji wieńcowej <50%, kurczliwość maleje proporcjonalnie do stopnia ograniczenia, a zasoby ATP i CrP są odbudowywane i osiągają normalny poziom. Ten stan nazywamy hibernacją miokardium. Występuje w nim obniżony przepływ i kurczliwość, ale zachowany jest bilans energetyczny.
Kiedy niedokrwienie jest krótkotrwałe lub o małym natężeniu, co skutkuje tym iż do czasu reperfuzji komórki nie uległy obumarciu, mówimy o ogłuszeniu mięśnia serca. Proces ten dzielimy na fazę ostrą, w której dochodzi do trawienia białek
kurczliwych i zmianach obniżających efektywną pracę mechaniczną komórek miokardium, oraz na fazę przewlekłą, gdzie dochodzi do zaniku aparatu kurczliwego i wykrywanej zmniejszonej ekspresji białek kurczliwych33.
W związku z powyższym pojawiło się pytanie czy hibernacja to rezultat postępującego niedokrwienia ze zmniejszonym przepływem wieńcowym, czy też powtarzający się cykl niedokrwienie-reperfuzja z ciągłym ogłuszaniem bez zredukowanego przepływu wieńcowego.31 Przed odpowiedzią na powyższe pytanie zostaną omówione wyżej opisane procesy, wraz z podziałem na typy niedokrwienia miokardium.
1.2.2 Niedokrwienie spoczynkowe i wysiłkowe
Patofizjologicznie wyróżniamy dwa typy niedokrwienia. Ich podział jest zależny od mechanizmu, który je powoduje. W pierwszym przypadku mówimy o ograniczeniu lub zatrzymaniu perfuzji spoczynkowej (z ang. Supply ischemia). Natomiast drugi to konsekwencja niewystarczającego przepływu wieńcowego w czasie wysiłku (z ang. Demand-induced ischemia). Oba powyższe stany zostały opisane poniżej.
1.2.2.1 Niedokrwienie spoczynkowe
Jako podstawową manifestację niedokrwienia spoczynkowego uznajemy zawał serca i inne stany, które są wynikiem istotnego zwężenia lub całkowitego zamknięcia nasierdziowego naczynia wieńcowego. Idealnym modelem do tego typu niedokrwienia są serca świń, królika i szczura. W przeciwieństwie do ludzkiego – nie posiadają krążenia obocznego, co w przypadku niedrożności naczynia wieńcowego skutkuje całkowitym zatrzymaniem perfuzji i powstaniem pełnościennego (transmuralnego) zawału serca w czasie ok. 30 minut od wystąpienia niedokrwienia.
U ludzi z racji krążenia obocznego całkowita stenoza naczynia wieńcowego skutkuje częściowym i nie homogennym spadkiem perfuzji w dorzeczu danej tętnicy. Spadek ten jest zdecydowanie większy w warstwie podwsierdziowej i w epicentrum zawału, skąd stopniowo maleje do jego obrzeży34. Osłabienie siły skurczu następuje w ciągu kilku sekund od zamknięcia naczynia.
Kolejność zmian kurczliwości przy angioplastykach wieńcowych już 1985 roku 35 opisał Hauser. Stwierdził on wystąpienie hipokinezy progresującej do dyskinezy już w 19±8 sekundzie od napełnienia balonu. Kurczliwość normalizowała się od 17± 8 sekundy po opróżnieniu balonu.
Rycina 1. Transmuralny profil perfuzji wieńcowej w ścianie lewej komory w normie i w ostrym zespole wieńcowym. (za A. Beręsewicz30)
Na osi poziomej przedstawiono grubość ściany komory od epikardium do endokardium. Prawidłowo przepływ w warstwie podwsierdziowej jest większy niż w warstwie podnasierdziowej. W przypadku niedrożności naczynia wieńcowego mamy do czynienia z odwróconym profilem przepływu. Jest on większy w warstwie podnasierdziowej niż w podwsierdziowej. Stopień ograniczenia przepływu zależy od wielu czynników (m.in. stopnia stenozy naczynia czy wielkości krążenia obocznego).
1.2.2.2 Niedokrwienie wysiłkowe
To statystycznie najczęściej spotykany typ niedokrwienia. Występuje on u osób ze stabilną chorobą wieńcową i rezydualną stenozą naczynia wieńcowego. Szacuje się, że do 8% takich epizodów przebiega bezbólowo – tzw. ciche niedokrwienie (silent ischemia)36.
DJ. Duncker w 2008 roku opisał rodzaje stenoz naczyń powodujących zmianę w przepływie. I tak zmniejszenie średnicy naczynia poniżej 85% pozostało bez
0 0,2 0,4 0,6 0,8 1 1,2 1,4 1 2 3 4 5 6 Perfu zja wi eń co wa ml /g/ mi n Epikardium >>>> Endokardium
Transmuralny profil perfuzji wieńcowej
norma zawał
wpływu na spoczynkowy przepływ, zaś pomiędzy 50-85% ograniczona zostaje rezerwa wieńcowa.37
W przypadku ograniczonej rezerwy wieńcowej niedobór perfuzji powstaje w wyniku zwiększonego obciążenia skurczowego miokardium np: przy wysiłku fizycznym, stymulacji współczulnej bądź też jest indukowany farmakologicznie podaniem katecholamin lub adenozyny. Skutkuje to wzrostem stężenia produkowanego w miokardium kwasu mlekowego (marker glikolizy beztlenowej), postępującym obniżeniem odcinka ST w EKG, a następnie pojawieniem się bólu wieńcowego i zaburzeniami funkcji miokardium pod postacią wzrostu ciśnienia końcoworozkurczowego w lewej komorze. Po normalizacji obciążenia miokardium zmiany ustępują w przeciągu minut.36
Jako obserwowany efekt tego zmniejszonego przepływu wieńcowego, jest brak równowagi pomiędzy zapotrzebowaniem, a podażą na tlen i substancje odżywcze w miokardium. Proces ten spełnia kryteria definicji niedokrwienia.
Rycina 2. Zmiana przepływu w naczyniach wieńcowych w niedokrwieniu (za Duncker DJ37)
Rycina 2 pokazuje część tętniczą unaczynienia wieńcowego lewej komory serca i wskazanie trzech składowych oporu wieńcowego: w spoczynku i w czasie wysiłku w normie oraz w spoczynku i wysiłku w obecności istotnego zwężenia tętnicy nasierdziowej .
Strzałki i ich grubość reprezentują wypadkowy kierunek i wielkość przepływu krwi. Zmiana przepływu jest zależna od oporu;
opór całkowity = Rc + Rk + RA.
Rc – opór czynnościowy (tonus naczyń – napięcie mięśni gładkich);
Rk – opór kompresyjny (związany z uciskiem wywołanym zewnątrz (skurcz miokardium) – zaprezentowany w sposób nasilony w wysiłku w przypadku zwężenia naczynia);
RA – opór anatomiczny (stały, wzrasta w przypadku istotnego zwężenia naczynia)
1.2.3 Ogłuszenie miokardium
Zaburzenie kurczliwości miokardium znane jako ogłuszenie mięśnia sercowego występuje nie tylko w niedokrwieniu. Również niejednokrotnie może być następstwem reperfuzji w dorzeczu wcześniej zamkniętej tętnicy. Te zaburzenia kurczliwości występują pomimo obecności prawidłowej perfuzji wieńcowej, ale po wcześniejszym jej ograniczeniu. Oznacza to, że ogłuszenie może występować w niedokrwieniu wysiłkowym, jak też w spoczynkowym.
W zależności od czasu trwania niedokrwienia również czas powrotu funkcji miokardium jest wprost proporcjonalnie wydłużony. W przypadku występowania mnogich incydentów niedokrwienia i reperfuzji, powstaje tzw. ogłuszenie przewlekłe.
1.2.3.1 Ogłuszenie ostre
W wyniki krótkotrwałego spadku przepływu, w okresie reperfuzji enzymatycznemu trawieniu przez kalpainę ulegają białka kurczliwe w tym troponina-T. Jest to proces zależny od jonów Ca2+, podobnie jak wzrost stężenia ATP-azy rozkładającej ATP i utratę energii na procesy niezwiązane ze skurczem. W związku z powyższym spada efektywność mechaniczna mięśnia, a co za tym idzie jego siła skurczu.37,38 Istnieje możliwość przezwyciężenia powyższych procesów w wyniku
zwiększenia stężenia jonów Ca2+ w kardiomiocytach poprzez zastosowanie
katecholamin.
Rycina 3. Schemat postępujących zmian w przypadku ogłuszenia ostrego (za M.O. Jeroudi 38)
1.2.3.2 Ogłuszenie przewlekłe
Ogłuszenie przewlekłe jest obszarem, w którym patofizjologicznie nie doszło do spoczynkowego niedokrwienia, bądź hibernacji. Przepływ spoczynkowy jest w normie, natomiast występują liczne, sumujące się, krótkotrwałe epizody niedokrwienia wysiłkowego, wielokrotnie nieme.39
Nasilenie ogłuszenia koreluje z wielkością ograniczenia rezerwy wieńcowej. Liczne opisy badań perfuzji przy zaburzeniach kurczliwości ocenione w PET pokazały, że obszary o zaburzonej kurczliwości mają taką samą perfuzję spoczynkową, ale brak rezerwy względem segmentów kontrolnych.40,41
NIEDOKRWIENIE-‐
REPERFUZJA
komórkowa akumulacja jonów Ca2+
wzrost Ca2+
zależnej kalpainy
trawienie troponiny T
spadek wrażliwości troponiny na Ca2+
spadek kurczliwości wzrost Ca2+ zależnej ATP-‐azy szybkie trwonienie ATP spadek efektywności mechanicznej
Tabela 1: Spoczynkowy przepływ wieńcowy i rezerwa wieńcowa w kontrolnych obszarach lewej komory i obszarach z odwracalnymi zaburzeniami kurczliwości u pacjentów z choroba wieńcowa w oparciu o badanie PET-CT (za Bolli42)
Segment miokardium lewej komory Perfuzja spoczynkowa (ml/min/g) Perfuzja wysiłkowa po podaniu dipirydamolu (ml/min/g) Rezerwa wieńcowa (%) Kontrolny 0,78 +/- 0,1 2,38 +/- 0,5 305 Ogłuszony 0,88 +/- 0,2 1,12 +/- 0,4 127
W literaturze dysponujemy nielicznymi opisami histologicznymi zmian w obszarach z lokalnymi odwracalnymi zaburzeniami kurczliwości. Badania wykonane za pomocą biopsji cienkoigłowych pokazały różne stadia degeneracji tkanki mięśniowej serca do ich zastąpienia przez tkankę łączną.40,41 Proces rozpoczynał się od postępującej utraty aparatu kurczliwego, a kończył na apoptozie kardiomiocytów.
Kiedy powyższy proces zostanie przerwany przez udrożnienie zamkniętych tętnic (plastyka naczynia wieńcowego, CABG), powrót kurczliwości będzie procesem długotrwałym, liczonym nawet w miesiącach i w zależności od stopnia ogłuszenia niekompletnym.
1.2.4 Hibernujące miokardium 1.2.4.1 Hibernacja ostra
Natychmiastowa utrata kurczliwości w kilka sekund od wystąpienia bodźca niedokrwiennego opisywana jest już jako hibernacja. Wyłączenie mechanizmu skurczu – opisywane jako obrona kardiomiocytów, pozwala zaoszczędzić ok. 80% obecnego w cytozolu ATP, które może zostać przeznaczone na procesy życiowe. Postuluje się, że w przypadku niedokrwienia spoczynkowego mechanizm hibernacji działa bardzo krótko, natomiast w przypadku niedokrwienia wywołanego umiarkowanie ograniczoną spoczynkową perfuzją wieńcową, hibernacja pozwala przeżyć nawet kilkunastogodzinne okresy niedokrwienia. Są to hipotezy opublikowane przez Zhang’a43 i Shen’a44 odpowiednio w 1997 i 1996 roku.
Zhang prowadząc badania na sercach psów, oraz Shen na sercach świń zakładali podwiązkę tak, by ograniczenie spoczynkowej perfuzji wieńcowej wynosiło ok 30-50% wartości należnej. Pokazali oni, że kurczliwość malała wprost
proporcjonalnie do ograniczenia przepływu (perfusion-contraction-matching) i na tym poziomie się utrzymywała przez dalszą część eksperymentu. W reperfuzji normalizacja siły skurczu miokardium trwała bardzo powoli, ale też powracała bezstratnie.
Na poziomie biochemicznym zauważyli znaczy spadek stężenia ATP i CrP, które na przełomie godziny normalizowały się i na takim poziomie utrzymywały. Po upływie godziny w kardiomiocytach nie zanotowano zaburzeń metabolicznych jedyną widoczną cechą pozostawały zaburzenia kurczliwości. Stężenie uznanego powszechnie wskaźnika niedokrwienia w postaci ilości kwasu mlekowego we krwi wzrastało w pierwszych minutach, co wskazywało na jego nadmierną produkcję przez kardiomiocyty. Jednakże po 90 minutach mięsień sercowy ponownie stawał się jego konsumentem.
Powyższe modele eksperymentalne udowadniające obecność hibernacji ostrej, niestety nie pozwoliły na ocenę i potwierdzenie istnienia procesu hibernacji przewlekłej. Przyczyną tego stanu jest rozwoju krążenia obocznego, które dąży do zapewnienia normalnej spoczynkowej perfuzji miokardium na obszarze zaopatrywanym przez zwężone naczynie. Występuje to na przełomie tygodnia czasu od wystąpienia bodźca.
Tabela 2. Cechy charakterystyczne krótkoterminowej - ostrej hibernacji (za Zhang43) Cechy charakterystyczne krótkoterminowej - ostrej hibernacji
Nieprzerwany balans pomiędzy obszarem o zredukowanym przepływie krwi, a jego zaburzoną funkcją skurczową (sustained perfusion-contraction-matching)
Powrót do wartości prawidłowych parametrów biochemicznych (CKMB, mleczanów) mimo trwającego niedokrwienia
Rekrutowalna rezerwa kurczliwości po odzyskaniu prawidłowego metabolizmu Odzyskanie funkcji skurczowej po reperfuzji
Brak nekrozy
1.2.4.2 Hibernacja przewlekła
Badania hibernacji ostrej nie potwierdziły hipotez istnienia też formy przewlekłej hibernacji zaproponowanej przez twórcę terminu
(perfusion-contraction-matching) Ross’a, jednakże rozbudziły entuzjazm naukowców i skierowały poszukiwania na inne tory.34
Z patofizjologii niedokrwienia zwrócono się również w kierunku biochemicznych procesów mających miejsce w niedokrwieniu. Z niewystarczającego przepływu, który uniemożliwia pracę miokardium w pełnym jego zakresie funkcji, do stanu w którym przepływ krwi jest nieadekwatny do utrzymania stabilnego poziomu metabolizmu.45
W chwili obecnej większość badań eksperymentalnych nie podejmuje się oceny poprawy funkcji skurczowej po reperfuzji, co jest znakiem charakterystycznym dla hibernacji. Poszukiwania ukierunkowane są na obecność obszarów zawału, czasu i miejsca powstania nekrozy, przy założeniu obecności hibernacji jako następstwa procesów metabolicznych i biochemicznych przewlekłego ogłuszenia.
Z definicji przewlekłe ogłuszenie jest procesem występującym przy prawidłowym przepływie spoczynkowym w sytuacji licznych, następujących po sobie epizodów niedokrwienia. W sytuacji, gdy dodatkowo dochodzi w ogłuszonym miokardium do zmniejszenia przepływu spoczynkowego, komórki ulegają hibernacji.
Nie ogranicza się ona tylko do zaburzeń kurczliwości poprzez zahamowanie i degradację aparatu kurczliwego. W hibernacji przewlekłej będącej następstwem ogłuszenia, następuje w zależności od ograniczenia przepływu powolna degeneracja kardiomiocytów.
Tabela 3. Cechy morfologiczne przewlekłej hibernacji (za Shen YT.44)
Przebudowa kardiomiocytów
Utrata miofilamentów Utrata siateczki sarkoplazmatycznej
Utrata koneksyny-43
Dużo małych, napęczniałych (pączkowatych) mitochondriów Dezorganizacja cytoszkieletu (desmosyny, tubuliny, wimentyny) Sekwestracja cząstek komórki do przestrzeni międzykomórkowej
Atrofia APOPTOZA
Przebudowa tkanki śródmiąższowej
Zwiększona ilość cytoplazmy i białek strukturalnych (fibronektyny i kolagenów) Wzrost ilości – napływanie makrofagów i fibroblastów
Mechanizm patofizjologiczny został opisany przez C. Chen’a na modelu hibernacji mięśnia sercowego świni. W mikroskopie elektronowym opisał on utratę miofilamentów i sarkomerów oraz wzrost poziomu glikogenu.46
Kolejnych dowodów na istnienie hibernacji przewlekłej i jej patomechanizmu dostarczyli JA. Fallavollita,47 EO. McFalls48 oraz I. Mills49, którzy w tkankach spełniających kryterium przewlekłej hibernacji nie znaleźli martwicy, ale opisywali obszary włóknienia i ogólny wzrost ilości tkanki łącznej do dwukrotnej ilości w stanie normalnym. Kiedy YT. Shen opisał na modelu świń przy upośledzonym, ale nie redukowanym przepływie regionalnym krwi w dysfunkcyjnym miokardium liczne obszary włóknienia otoczone przez obwódki kardiomiocytów z lizą miofibryli i zwiększoną ilością glikogenu.44 Natychmiast jego badania porównano z wcześniejszymi doniesieniami o fenotypie zmian w ludzkim hibernującym miokardium.
Jednocześnie C. Chen opisał mechanizm apoptozy w komórkach miokardium50. Liczba komórek ulegających apoptozie nie zmieniała się, ani po 7 dniach, ani 4 tygodniach od pierwotnego badania. Jednocześnie wskazał na bezpośrednią korelację częstości apoptozy, z ciężkością hipoperfuzji miokardium.
Cztery lata przed zdefiniowaniem przez Ramithool’a w 1985 pojęcia hibernacji mięśnia sercowego30, jego wykładniki morfologiczne u ludzi opisał Flameng51.
Wykonał on biopsję mięśnia sercowego, który był wcześniej dysfunkcyjny, a po rewaskularyzacji uległ regeneracji. W badanych próbkach miokardium opisał utratę kardiomiocytów, w pozostałych próbkach zmiany w samych kardiomiocytach pod postacią utraty aparatu kurczliwego oraz wzrostu depozytów glikogenu. Opisał on również cechy śródmiąższowego włóknienia.
Od tamtej pory liczne badania potwierdziły te obserwacje52 , 53 , 54 , 55 , 56 , 57, dodatkowo opisując dużo małych „pączkowatych” mitochondriów52,54,55, redukcję siateczki sarkoplazmatycznej51,52, utratę kontaktu pomiędzy wewnętrzną i zewnętrzną błoną mitochondrialną, co redukuje możliwość fosforylacji oksydacyjnej i aktywności mitochondrialnej kinazy kreatyninowej58. Zewnątrzkomórkowa ilość kolagenu i fibronektyny oraz objętość matrix wzrasta54,55,59 , dodatkowo pojawia się zwiększona liczba makrofagów i fibroblastów.54
W mikrokrążeniu wieńcowym również powstają zmiany o charakterze przerostu mniejszych mikronaczyń i atrofii większych mikronaczyń.60 , 61 Warto również podkreślić, że powyższe badania wykonywano z biopsji miokardialnej,
więc nie ma możliwości oceny całego obszaru hibernacji i najpewniej nie jest dla niego reprezentatywne. W różnych miejscach hibernowanego miokardium, kardiomiocyty mogą być w różnym stopniu zmienione. W związku z powyższymi zmianami możliwość regeneracji funkcji skurczowej miokardium w niektórych badaniach koreluje z ilością tkanki włóknistej55,57, a w niektórych takiej korelacji nie wykazano56.
1.2.5 Zawał mięśnia sercowego
Celem dopełnienia definicji zawartych powyżej nie sposób nie wspomnieć o zawale mięśnia sercowego. Zawał mięśnia jest następstwem niedokrwienia na skutek dysproporcji pomiędzy przepływem wieńcowym, a zapotrzebowaniem na niego62. Definicja ta udoskonalona obecnie w trzecim wydaniu brzmi, że jest to sytuacja kliniczna wskazująca na ostre niedokrwienie mięśnia sercowego przy dowodach na obecność martwicy mięśnia sercowego.63 Z powyższą definicją
opublikowana została pięciostopniowa klasyfikacja zawału serca. Dokładna klasyfikacja została zawarta w metodach tego badania.
Rycina 4. Schematyczne przedstawienie przyczyn zawałów pierwszego i drugiego typu.
Śmierć kardiomiocytów w ostro niedokrwionym miokardium jest wynikiem głównie martwicy (nekrozy), podczas gdy we wcześniej opisanym ogłuszeniu lub hibernacji wynika głównie z mechanizmu apoptozy.
Martwica zawałowa, w przypadku braku reperfuzji, to postać martwicy skrzepowej, w której martwe komórki tworzą skrzep. Z powodu niedoboru ATP, a następnie pęknięcia błony komórkowej, zawartość kardiomiocytu przedostaje się do przestrzeni pozakomórkowej i aktywuje odczyn zapalny.
Białka komórkowe przedostają się do krwi krążącej, gdzie są identyfikowane jako markery zawału serca. Warto tutaj zauważyć, że w przypadku apoptozy nie mamy do czynienia z reakcją zapalną i uwolnieniem markerów biochemicznych do krwi. Dlatego rozróźnienie obszarów z martwicą lub apoptozą możliwe jest jedynie w oparciu o techniki histologiczne.34
Kiedy po wystąpieniu zawału dokonana zostanie reperfuzja, spotykamy martwicę z węzłami skurczu. Wtórnie do powyższych zmian pękają błony komórkowe i również uwalnianie są biochemiczne markery zawału mięśnia sercowego. Jako determinanty wielkości zawału mięśnia sercowego wymienia się wielkość rezydualnego przepływu jak również wielkość obszaru zaopatrywanego przez niedrożną tętnicę.
Tabela 4. Typy niedokrwienia miokardium i ich charakterystyka (za Beręsewicz 34) Niedokrwienie letalne
Z rezydualną perfuzją miokardium <20%. W tych warunkach skurcz zanika w ciągu kilkunastu sekund, a komórkowe poziomy ATP i CrP spadają do wartości krytycznych w ciągu 20-40 minut i w tym czasie dochodzi do martwicy komórek. Obszar niedokrwiony w stopniu letalnym może uratować jedynie reperfuzja wykonana prawie
natychmiast po wystąpieniu niedokrwienia
Niedokrwienie krytyczne
Z 20-40% rezydualnym przepływem. W wyniku takiego niedokrwienia skurcz zanika również w ciągu sekund, natomiast dynamika wyczerpywania się komórkowych zasobów ATP i CrP jest wolniejsza i do martwicy komórek
dochodzi w ciągu 6-12 godzin od początku niedokrwienia. Mięsień niedokrwiony krytycznie może uratować jedynie reperfuzja. Badania eksperymentalne pokazują że w obecności 20-30% przepływu, martwicy może zapobiec reperfuzja następująca nie później niż w ciągu 1-2 godzin od początku niedokrwienia. W obecności ok.
40% rezydualnego przepływu czas ten wydłuża się do około 6-12 godzin
Niedokrwienie tolerowane
W przypadku obszarów mniejszych od 15% masy mięśnia lewej komory szacuje się, że do martwicy prawie w ogóle nie dochodzi, z racji wystarczalności procesów dyfuzji. Nasilenie powikłań, a co za tym idzie rokowanie pacjenta, zależą w głównej mierze od wielkości martwicy zawałowej.
Proces zapalny, który towarzyszy martwicy zawałowej rozwija się w ok. 40 minut od zamknięcia naczynia dozawałowego.64 Degradacja kolagenu staje się zauważalna w dobę po incydencie, osiąga zaś całkowitą degenerację w pierwszym tygodniu. Miofibroblasty pojawiające się w strefie zapalenia rozpoczynają odbudowywanie nowej sieci kolagenu celem organizacji blizny pozawałowej.65 Jest to zadanie bardzo trudne biorąc pod uwagę ciągły skurcz i rozkurcz serca. Po około kilku tygodniach tworzy się blizna oparta na stabilnej strukturze kolagenu, w której obumarłe kardiomiocyty zostają zastąpione tkanką łączną – potocznie nazywaną „blizną”.
2.
C
ELB
ADANIA2.1. Wprowadzenie - zaplanowanie badania
W 2011 roku opublikowano w New England Journal of Medicine (NEJM) wyniki wieloośrodkowego międzynarodowego badania STICH66, które wywołało wiele kontrowersji w środowisku kardiologów i kardiochirurgów. Badanie to dotyczyło również leczenia chorych z niewydolnością serca i nie udowodniło korzyści z rewaskularyzacji bezpośredniej mięśnia sercowego.
W międzyczasie trwało badanie SYNTAX, którego oficjalne pięcioletnie wyniki zostały przedstawione w Lancet w lutym 2013 roku. 67
Oba powyższe badania są obecnie licznie analizowane i wytyczyły ścieżki rozwoju kardiochirurgii na przyszłość. Stały się również podstawą tej rozprawy.
Kiedy badanie STICH poddawano kolejnym analizom, w tym również jego ramię, które obejmowało ocenę żywotności u chorych z upośledzoną funkcją skurczową lewej komory, wskazywano wielokrotnie na jego liczne ograniczenia, ale też na ważne założenia. Jednocześnie rozwój technik diagnostycznych i wzrost dostępności do badania żywotności mięśnia sercowego w oparciu o kardiologiczny rezonans magnetyczny, pozwoliło na zastosowanie narzędzia, na którym dotychczas nie diagnozowano chorych na niewydolność serca.
Również sami autorzy badania STICH68, jak i korespondenci NEJM69 wskazywali na konieczność użycia lepszego narzędzia w ocenie miokardium chorych na niewydolność serca planowanych do rewaskularyzacji, w tym też wskazywali na możliwości kardiologicznego rezonansu magnetycznego.
Dodatkowo nie publikowano przed 2012 rokiem żadnego badania z grupą chorych na niewydolność serca, z ocenioną przed operacją kardiochirurgiczną funkcją miokardium, za pomocą badania rezonansu magnetycznego.
Badanie to zostało zaplanowane na podstawie badań kliniczych STICH oraz SYNTAX, biorąc pod uwagę ich ograniczenia. W związku z powyższym rozprawa ta wnosi nowe informacje dotyczące chorych na skurczową niewydolność lewej komory, poddawanych zabiegowi bezpośredniej rewaskularyzacji mięśnia sercowego.
2.2 Cele badania
W badanej próbie klinicznej postawiono trzy cele badawcze:
1. Ocena wpływu rewaskularyzacji mięśnia sercowego na zmianę kurczliwości lewej komory u chorych z upośledzoną jej funkcją skurczową w okresie przedoperacyjnym
2. Wpływ bezpośredniej rewaskularyzacji mięśnia sercowego na poprawę kurczliwości segmentarnej w zależności od przezścienności (transmuralności) obszaru zwłóknienia w poszczególnych segmentach
3. Wpływ bezpośredniej rewaskularyzacji mięśnia sercowego na zmianę kurczliwości w segmentach hibernowanych i ogłuszonych mięśnia lewej komory
3.
M
ATERIAŁ I METODY3.1 Zgoda na przeprowadzenie i finansowanie badania
Praca badawcza w całym swoim zakresie uzyskała zgodę komisji bioetycznej nr 500/12 z dnia 10.05.2012, ze zmianami z dnia 04.10.2012 nr 909/12. (załącznik 10.5)
Na realizację niniejszej pracy został przeznaczony Uczelniany grant z zakresu finansowania młodych naukowców Uniwersytetu Medycznego im. Karola Marcinkowskiego w Poznaniu nr 502-14-02202306-50359.
3.2 Kryteria kwalifikacji oraz wyłączenia z badania.
Do badania zaplanowanego jako prospektywne w okresie od maja 2012 roku do marca 2014 włączono 50 kolejnych chorych, spełniających kryteria włączenia.
Zakwalifikowano chorych z izolowaną chorobą niedokrwienną serca i niewydolnością skurczową lewej komory LVEF>15% i <40%, stwierdzoną w przedoperacyjnym badaniu echokardiograficznym i potwierdzoną w badaniu rezonansu magnetycznego.
Jako kryteria wykluczenia uznano czynniki, które mogą mieć bezpośredni wpływ na wynik tego badania:
I. Współistniejąca inna wada serca i/lub aorty wymagająca jednoczasowego leczenia chirurgicznego
II. Świeży zawał serca (< 60 dni od Ostrego Zespołu Wieńcowego)
III. Wstrząs kardiogenny, zdefiniowany jako stan wymagający ciągłego wlewu leków inotropowo-dodatnich, bądź IABP zastosowane ze wskazań życiowych IV. Planowane leczenie hybrydowe (bezpośrednia rewaskularyzacja + PTCA)
V. Bezpośrednia rewaskularyzacja mięśnia sercowego w wywiadzie
VI. Współistniejąca choroba o przewidywanym czasie przeżycia chorego <12 miesięcy
VII. Udział w badaniach klinicznych leków III fazy o potencjalnym wpływie na układ sercowo-naczyniowy
VIII. Obecność urządzeń ferromagnetycznych uniemożliwiających wykonanie badania MRI (np: ICD)
Rycina 5. Przebieg kwalifikacji do grupy badanej
3.3 Procedura zabiegu operacyjnego
Wszyscy chorzy po diagnostyce przedoperacyjnej zostali poddani zabiegowi bezpośredniej rewaskularyzacji mięśnia sercowego z dostępu przez sternotomię pośrodkową. U każdego z pacjentów zastosowano taki sam protokół postępowania anestezjologicznego i prowadzenia krążenia pozaustrojowego lub zabiegu na bijącym sercu.
Chorzy w premedykacji otrzymali Temazepam (Signopam) 10 mg (p.o.) godzinę przed przyjęciem na salę operacyjną. Przed indukcją znieczulenia wprowadzona została kaniula żylna o średnicy 16G (1,7 mm) do żyły obwodowej przedramienia oraz w znieczuleniu miejscowym, kaniula tętnicza 20G (1,1mm) do tętnicy promieniowej.
Od tego momentu pomiar ciśnienia tętniczego wykonywano metodą inwazyjną. Wprowadzenie do zabiegu operacyjnego uzyskano po podaniu Midanium 0,04-0,05 mg/kg m.c., Fentanylu 2-3 µg/kg m.c., Etomidatu 0,25 mg/kg m.c., zwiotczenie mięśni pozwalające przeprowadzić intubację dotchawiczą po podaniu Pancuronium 0,1 mg/kg m.c. Po intubacji dotchawiczej wdrożona została wentylacja mechaniczna kontrolowaną objętością. Wstępne ustawienia takie jak: objętość oddechowa (Vt) 5-7 ml/kg, częstość oddechów (f) 12/min, stężenia tlenu w mieszaninie oddechowej (FiO2) 0,5; korygowano według końcowo-wydechowego
111 kolejnych chorych (kryterium LVEF w echokardiografii) 51 chorych zakwalifikowanych do badania cMR 60 chorych (kryterium wyłączenia) 51 chorych zakwalifikowanych do badania cMR 1 chory (rezygnacja z badania cMR -‐ klaustrofobia) 50 chorych grupa badana
stężenia CO2 (etCO2) docelowo 4,0-4,7 kPa. Głębokość znieczulenia oceniana była przy pomocy monitora indeksu bispektralnego BIS (metoda oceny głębokości znieczulenia oparta na analizie sygnału EEG).
Przez prawą żyłę podobojczykową wprowadzono cewnik trójdrożny do okołooperacyjnej infuzji leków. Znieczulenie ogólne podtrzymywane było infuzją propofolu i isofluranu pod kontrolą wartości BIS. Infuzja fentanylu w dawce 20 µg/kg została ponownie podana przed rozcięciem mostka. Chorzy otrzymali profilaktykę antybiotykową, zgodną z zaleceniami Komisji ds. Zakażeń Szpitalnych w formie dożylnego preparatu cefalosporyny II generacji (Tarfazolin) w dawce 1,0 grama w czasie 1 godziny przed zabiegiem operacyjnym, a także w trzech kolejnych dobach hospitalizacji trzy razy dziennie co 8 godzin.
Mycie pola operacyjnego wykonano dwukrotnie z zastosowaniem preparatu Braunoderm (1%, 10 mg/g; Alcohol isopropylicus + Povidonum iodinatum; Braun, Niemcy) u chorych operowanych w 2012 roku. Od 2013 roku w związku z nowymi zaleceniami komitetu ds. zakażeń stosowano preparat Spirytusu skażonego 0,5% Hibitanem (skład w 100g preparatu Chlorhexidini digluconas 0,5g, Ethanolum (760 g/l) 65,0g, Aqua purificata 34,5g)
W przypadku zabiegu prowadzonego bez użycia krążenia pozaustrojowego (na bijącym sercu), stabilizacje serca wykonywano za pomocą urządzenia Octopus Evolution AS Tissue Stabilizer (Medtronic Inc. USA). W przypadku niestabilności hemodynamicznej wykonywano konwersję do zabiegu w krążeniu pozaustrojowym.
U chorych u których zdecydowano się na krążenie pozaustrojowe, prowadzono je w warunkach umiarkowanej hipotermii (28oC). Kaniulowano aortę wstępującą oraz prawy przedsionek na wspólny spływ żylny. Przepływ krwi przez urządzenie płuco-serce ustawiono w temperaturze 28oC według przelicznika 2,4 l/min/m2 tak, aby średnie ciśnienie tętnicze pozostawało w graniach 50-70 mmHg.
Jako protekcję mięśnia sercowego w trakcie CPB stosowano zimny (4oC), wysokopotasowy (16 mEq/l) płyn krystaloidowy, sporządzony według formuły szpitala św. Tomasza w Londynie. Podawano go w dawce 10 ml/kg m.c. do opuszki aorty. Infuzję w wielkości połowy tak wyliczonej dawki powtarzano co 20 minut. Temperaturę ciała monitorowano za pomocą sondy umieszczonej w noso-gardzieli.
Heparynę (Heparinum) podawano we wstępnej dawce 10 000 j.m. i dalej jej stężenie korygowano wg docelowego czasu ACT. Dla zabiegów on-pump 450-550 sek, dla zabiegów off-pump 350 sek.
Zabiegi zostały wykonane przez zespół specjalistów kardiochirurgów z dużym doświadczeniem w obu technikach.
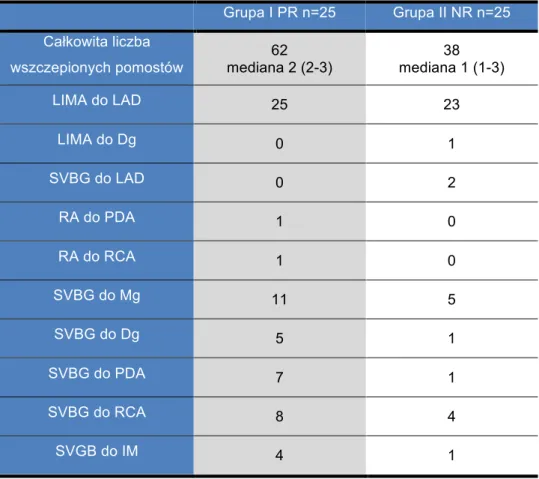
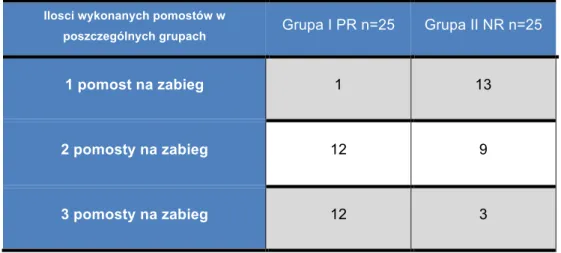
Poniżej w tabeli nr 5 przedstawiono liczbę zabiegów w krążeniu pozaustrojowym (CPB) (on-pump) vs. OPCAB (off-pump) oraz liczbę wszczepionych pomostów wieńcowych.
Tabela 5. Porównanie ilości zabiegów on-pump vs. off-pump i ilości wszczepionych pomostów wieńcowych w poszczególnych grupach badanych
Grupa I PR n=25 Grupa II NR n=25 P CPB/OPCAB CPB – 6 OPCAB -19 CPB – 4 OPCAB - 21 Ns Ns Liczba wszczepionych pomostów 62 mediana 2 (2-3) 38 mediana 1 (1-3) 0,000029
CPB – CardioPulmonary Bypass, OPCAB – Off-Pump Coronary Artery Bypass Ns- nonsignificant
3.4 Charakterystyka grupy badanej
Kolejno zoperowanych 50 chorych, podzielono na dwie grupy w zależności od wyników bezpośredniej rewaskularyzacji mięśnia sercowego.
Zgodnie z założeniem badania, gdy wykonano pełną zaplanowaną rewaskularyzację chorych włączono do grupy I – PR (pełna rewaskularyzacja). W przypadku gdy ze względu na różne czynniki, nie przeprowadzono pełnej rewaskularyzacji, chorych włączano do grupy II – NR (niepełna rewaskularyzacja).
Jako pełną rewaskularyzację w grupie badanej uznano wytyczne określone w powszechnie stosowanym w kardiochirurgii kryterium anatomicznym. Zakłada ono wszczepienie pomostów do wszystkich zwężonych naczyń nasierdziowych o wymiarze równym bądź większym niż 1,5mm z redukcja wymiaru większą, bądź równa 50% w przynajmniej 1 projekcji angiograficznej. 70 Na niepełność rewaskularyzacji w grupie badanej wpływały:
1. mały kaliber naczynia docelowego u 14 chorych - 14 odstąpionych pomostów 2. niemożność znalezienia naczynia natywnego u 4 chorych - 8 odstąpionych
pomostów
3. aorta porcelanowa u 5 chorych - 6 zaplanowanych pomostów 4. brak graftów u 3 chorych - 5 zaplanowanych pomostów
Dane grupy badanej przedstawiono w tabeli 6. Obserwacji końcowej nie wykonano u 4 chorych, z czego u jednego chorego ze względu na zgon w okresie okołooperacyjnym, dwóch w średnio-odległej obserwacji oraz u jednego chorego, który ze względu na zdiagnozowane wcześniej zaburzenia psychiczne i objawy silnej klaustrofobii nie poddał się badaniu kontrolnemu.
Tabela 6. Dane demograficzne i podstawowe przedoperacyjne parametry kliniczne
Grupa I PR n=25 Grupa II NR n=25 P Wiek (lata)
średnia +/- odch. stand. 62,92+-8,02 62,08 +/- 6,988 Ns
Płeć (M/K) Mężczyzn - 24 Kobiet - 1 Mężczyzn - 24 Kobiet - 1 Ns Wzrost (cm) mediana (min-max) 173 (159 - 188) 174 (155 - 180) Ns Waga (kg)
średnia +/- odch. stand. 84,44 +/- 14,709 84,72 +/- 14,1348 Ns
BMI
średnia +/- odch. stand. 28,55 +/- 4,18 28,61 +/- 4,45 Ns
Euroscore II logistic mediana (min-max) 1,35% (0,62 – 26,3) 1,5% (0,55 – 6,24) Ns CCS 0 – 0 (0%) I – 2 (8%) II – 6 (24%) III – 15 (60%) IV – 2 (8%) 0 – 0 (0%) I – 0 (0%) II – 10 (40%) III – 13 (52%) IV – 2 (8%) Ns Liczba incydentów wieńcowych w wywiadzie O – 6 (24%) 1 – 14 (56%) ≥2 – 5 (20%) 0 – 3 (12%) 1 – 20 (80%) ≥2 – 2 (8%) Ns Cukrzyca 9 (36%) 7 (28%) Ns Nadciśnienie 22 (88%) 21 (84%) Ns Dyslipidemia 17 (68%) 19 (76%) Ns Zmiany miażdżycowe w obwodowych naczyniach 23 (92%) 23 (92%) Ns Rytm zatokowy 21 (84%) 20 (80%) Ns Migotanie przedsionków 4 (16%) 5 (20%) Ns
BMI–body mass index, CCS-Canadian Cardiovascular Society, NR–niepełna rewaskularyzacja, Ns–nonsignificant (nieistotne statystycznie), PR–pełna rewaskularyzacja
Porównanie obu grup w każdym z badanych parametrów oceniono jako nieistotne statystycznie, w związku z powyższym stwierdzono, że obie grupy badane nie różnią się między sobą.
3.5 Badania przedoperacyjne
3.5.1 Badanie Echokardiograficzne
Chory byli włączeni do badania w przypadku stwierdzenia w rutynowym badaniu echokardiograficznym w standardzie M+2D+Doppler upośledzonej funkcji skurczowej lewej komory z obniżeniem jej frakcji wyrzutowej poniżej 40%, ale nie mniej niż 15%. Badanie wykonane było przez jednego z dwóch doświadczonych specjalistów kardiologów na aparacie EnVisor C (Philips Medical System – USA). Metoda obliczeń oparta została o wzór zmodyfikowanej metody Simsona (metoda sumacji dysków). Pomiary do powyższego wyliczenia zostały pobrane z dwóch projekcji koniuszkowych w rzutach czterojamowym i dwujamowym. Jeżeli pacjent nie spełniał kryteriów wykluczenia przedstawiono mu protokół badania klinicznego. Po uzyskaniu pisemnej zgody wykonano przedoperacyjne badanie Rezonansu Magnetycznego Serca.
3.5.2 Obrazowanie metodą rezonansu magnetycznego
U wszystkich badanych wykonano badanie rezonansu magnetycznego serca w Pracowni Rezonansu Magnetycznego przy I Klinice Kardiologii przed i 6 miesięcy po zabiegu CABG.
Badanie MR serca wykonano przy użyciu 1,5-teslowego aparatu (Magnetom Avanto, Siemens, Tim System [76x18], Q-engine: 33 mT/m , 125 T/m/s). Podczas badania użyto 2 cewek: 6-elementową cewkę Body Matrix w połączeniu z sześcioma elementami 12-elementowej cewki Spine Matrix. W celu uzyskania najbardziej jednolitych obrazów wszystkie badania były bramkowane zapisem EKG oraz były wykonane na wstrzymanym oddechu chorego w końcowej fazie wydechu. Średni czas badania wynosił 45-60 min.
Badanie MR składało się z następujących elementów: ocena morfologiczna, ocena funkcji mięśnia sercowego, ocena perfuzji oraz ocena zwłóknienia, próba
obciążeniowa z niską dawką dobutaminy przed zabiegiem rewaskularyzacji, w celu określenia żywotności mięsnia sercowego w poszczególnych badanych segmentach.
Wstępna ocena morfologiczna opierała się na wykonaniu poprzecznych obrazów klatki piersiowej celem lokalizacji osi długiej i krótkiej serca. Uzyskano je przy pomocy techniki HASTE (Half-Fourier Acquisition Single-shot TurboSE). Dzięki temu możliwe jest uzyskanie nieruchomych obrazów podczas wstrzymanego oddechu badanego.
Ocenę czynności lewej komory oparto na obrazowaniu typu cine w sekwencji Steady State Free Precession (SSFP). Każdorazowo wykonano akwizycję w projekcji 2-, 3- i 4-jamowej oraz w projekcji osi krótkiej od podstawy do koniuszka lewej komory. Ilość projekcji w osi krótkiej zależała od wielkości serca: grubość warstw wynosiła 8mm z odstępami 2 mm (razem 10 mm na warstwę) przy rozdzielczości 2 x 2 mm przy czasowej rozdzielczości wynoszącej 25 klatek na cykl pracy serca. Na podstawie uzyskanych obrazów możliwa była ocena objętości końcowoskurczowej (end-systolic volume; ESV), końcoworozkurczowej (end-diastolic volume; EDV), frakcji wyrzutowej (ejection fraction; EF), objętości wyrzutowej (stroke volume; SV), pojemności minutowej (cardiac output; CO) oraz masy lewej komory. Objętość końcoworozkurczowa obliczona była w momencie, w którym krew zajmowała największą objętość, a objętość końcowoskurczowa w momencie, gdy krew zajmowała najmniejszą objętość lewej komory (rycina 6).
Rycina 6. Ocena funkcji mięśnia sercowego na podstawie obrazów rezonansu magnetycznego. A – kontury endokardium (kolor czerwony) i epikardium (kolor zielony) lewej komory oraz kontur endokardium prawej komory (kolor żółty) w fazie
końcowoskurczowej. B - kontury endokardium (kolor czerwony) i epikardium (kolor zielony) lewej komory oraz kontur endokardium prawej komory (kolor żółty) w fazie końcoworozkurczowej.
Obliczenia wykonano za pomocą metody wolumetrycznej, w której objętość komory w skurczu i rozkurczu obliczana jest jako suma powierzchni jamy lewej komory serii warstw w projekcji w osi krótkiej przemnożonych przez grubość warstwy. Do obliczeń wykorzystano program komputerowy dedykowany QMass (Medis, Holandia) (rycina 7). Frakcja oraz objętość wyrzutowa lewej komory wyznaczone zostały z następujących zależności:
SV = EDV – ESV, EF = !"#!" =!"#!!"#!"# .
Rycina 7. Ocena funkcji lewej komory na podstawie sumy powierzchni w serii warstw w projekcji w osi krótkiej przy użyciu programu QMass. Ocena masy lewej komory z uwzględnieniem mięśni brodawkowatych (linia czerwona – endokardium, linia zielona – epikardium, obszar zielony – miokardium).
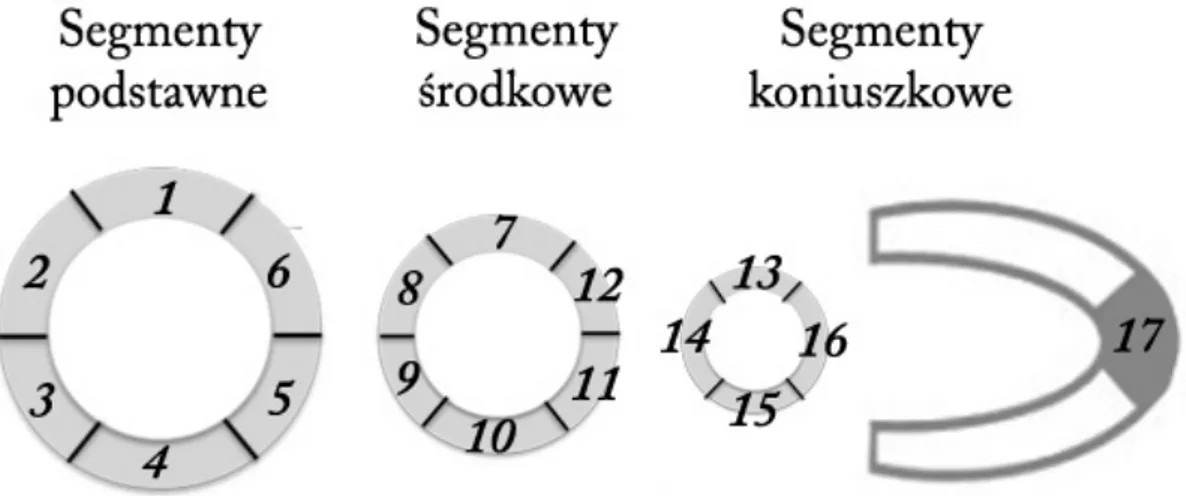
Funkcję mięśnia lewej komory oceniono również metodą wzrokową analogicznie do metod stosowanych w obrazowaniu echokardiograficznym, oceniając kurczliwość poszczególnych siedemnastu segmentów w projekcjach 2-, 3-, 4-jamowych jako: hiperkinezę, normokinezę, hipokinezę, akinezę lub dyskinezę.
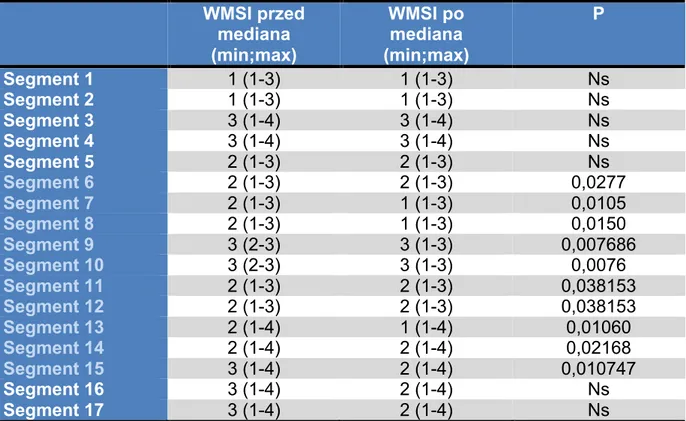
Obliczono wskaźnik ogólnej i odcinkowej kurczliwości WMSI (Wall Motion Score Index) wg. schematu przyporządkowania podanego w tabeli nr 7.
Tabela 7. WMSI – ocena ruchu danego segmentu
Ocena segmentu Wynik WMSI
Hiperkineza 0
Norma 1
Hipokineza 2
Akineza 3
Dyskineza 4
Oznacza to, że serce o prawidłowej czynności skurczowej ma wynik <=17 punktów. Im wyższa wartość wskaźnika WMSI, tym bardziej nasilone są zaburzenia kurczliwości lewej komory serca.
Rycina 8. Zastosowany w badaniu podział na 17 segmentów miokardium lewej komory
Tabela 8. Nazwy segmentów w 17 częściowym podziale miokardium lewej komory
Nr Nazwa Nr Nazwa Nr Nazwa Nr Nazwa
1 przedni 6 przednio-boczny 11 dolno-boczny 16 boczny
2 przednio-przegrodowy 7 przedni 12 przednio-boczny 17 koniuszek 3 dolno-przegrodowy 8 przednio-przegrodowy 13 przedni
4 dolny 9 dolno-przegrodowy 14 przegrodowy
Obrazowanie perfuzji mięśnia sercowego wykonane zostało na podstawie techniki pierwszego przejścia (first pass) środka kontrastowego zawierającego gadolin. Standardowo badanie to wykonuje się w trzech projekcjach w osi krótkiej: w segmentach podstawnych, środkowych i koniuszkowych oraz w projekcji w osi długiej w prezentacji dwu- i czterojamowej. W trakcie obrazowania użyto jednomolowego środka kontrastowego w dawce 1 mmol/kg masy ciała chorego.
Obrazy uzyskano przy pomocy T1-zależnej sekwencji gradient-echowej z
odczytem echoplanarnym typu single-shot. W tej technice grubość warstwy wynosiła 8 mm, a rozdzielczość w warstwie < 3 mm z zachowaną rozdzielczością czasową 100-125 ms, przy czym czas całej sekwencji obejmował 40-50 cykli, tak aby uwidoczniony został cały proces przejścia środka kontrastowego przez mięsień sercowy. Na podstawie wyników określono wielkość i strefę ubytku perfuzji w mięśniu sercowym.
Rycina 9. Wynik badania perfuzji spoczynkowej u chorego z grupy badanej – zaburzenia perfuzji zaznaczono strzałką
W celu oceny zwłóknienia mięśnia sercowego, w czasie 10-15 min od podania środka kontrastowego rejestrowano obrazy późnego wzmocnienia kontrastowego (Late Gadolinium Enhancement – LGE)
Rycina 10. Strefa pełnościennego zwłóknienia (czerwona strzałka) w ścianie przedniej serca w badaniu CMR u jednego z badanych pacjentów. Projekcja w osi krótkiej 15 minut po podaniu kontrastu gadolinowego.
Zastosowano sekwencję T1-zależną typu turbo flash z impulsem inwersyjnym.
W badaniu grubość warstwy wynosiła 10 mm przy rozdzielczości w warstwie 1,5 × 1,5 mm. Wszystkie obszary podnasierdziowego późnego wzmocnienia kontrastowego były sumowane. Każdorazowo porównywano obrazy LGE z wynikami badania perfuzji i kurczliwości w celu wykluczenia artefaktów.
Wielkość zawału oceniono przy pomocy metody szerokości połówkowej krzywej intensywności sygnału po podaniu kontrastu (Full Widith at Half Maximum; FWHM). Polega ona na wyselekcjonowaniu granicy obszarów zakontraktowanych jako obszarów powyżej 50% maksymalnej intensywności sygnału LGE, przy czym obszary braku wypełnienia kontrastem wśród wysokozakontrastowanego pola miokardium również zaliczano do wielkości zawału serca. Są to obszary uszkodzenia mikrokrążenia (microvascular obstruction; MVO), stąd nie napływa do nich środek cieniujący. Wielkość obszaru MVO obliczano jako wielkość obszaru pozbawionego kontrastu wśród strefy późnego wzmocnienia kontrastowego. Obie wielkości były mierzone półautomatyczną metodą planimetryczną odpowiednio jako suma powierzchni obszarów hiper- lub hipodensyjnych w mięśniu lewej komory w serii warstw w projekcji w osi krótkiej przemnożonych przez grubość warstwy (rycina 11).
Rycina 11. Ocena grubości martwicy w kolejnych przekrojach w różnych segmentach jednej ściany lewej komory u jednego z chorych badanych
Ilość warstw oraz ich rozdzielczość w każdym przypadku była analogiczna do parametrów ustawionych w sekwencjach SSFP. Do obliczeń wykorzystano również program dedykowany QMass (Medis, Holandia). Uzyskano w ten sposób wielkość objętości i masy zarówno blizny jak i MVO.
Oceniono ilość i przezścienność zajęcia przez zwłóknienie (bliznę) poszczególnych 17 segmentów w projekcjach 2-, 3- i 4-jamowych: w podziale na grupy 1 – 0-25%; 2 – 25-50%; 3 – 51-75%; 4 – >75%
Celem oceny rezerwy skurczowej w zahibernowanym mięśniu sercowym przeprowadzono badanie obciążeniowe z małą dawką dobutaminy (wlew z prędkoscią 10 mikrogramów/kg/min przez 5 minut). Przed badaniem odstawiano na 24 godziny beta adrenolityki i azotany oraz bezpośrednio przed wykonywano 12 odprowadzeniowe ekg. Monitorowano częstość pracy serca, oksymetrię, ciśnienie tętnicze. Oceniano zaburzenia kurczliwości wzrost lub spadek skurczowego przyrostu grubości przy uzyciu WMSI. Na szczycie wysiłku po podaniu środka kontrastowego oceniano ponownie perfuzję w poszczególnych segmentach lewej komory.